विलयन
विलयन क्या है? विलयन के प्रकार
दो या दो से अधिक अवयवों के समांगी मिश्रण को विलयन कहा जाता है। जैसे नमक तथा जल का मिश्रण, ऑक्सीजन तथा नाइट्रोजन का मिश्रण, चीनी तथा जल का मिश्रण आदि। विलयन को अंग्रेजी में शॉल्यूशन कहते हैं।
समांगी तथा असमांगी मिश्रण
समांगी मिश्रण
मिश्रण जिनके अवयवों के अंतर को देखा नही जा सकता है, समांगी मिश्रण कहलाते हैं। समांगी मिश्रण के संघटन एवं गुण सभी जगह एक समान होते हैं।
उदाहरणजल तथा नमक का विलयन (मिश्रण), जल तथा चीनी का विलयन (मिश्रण), जल तथा नींबू के रस का मिश्रण, नाइट्रोजन तथा ऑक्सीजन का मिश्रण, ब्रांज, आदि।
समांगी मिश्रण को अंग्रेजी में होमोजिनियश मिक्चर कहते हैं। "होमोजिनियस" ग्रीस (Greek) के दो शब्दों "होमोस (Homos)" तथा "जिनस (genos)" से मिलकर बना है। इसमें "होमो (Homo)" का अर्थ होता है "एक समान (same) या बराबर" तथा "जिनस (genos)" का अर्थ है "जाति, प्रकार या किस्म"। अर्थात "एक ही प्रकार का या एक ही जाति का"।
समांगी मिश्रण ही विलयन कहलाते हैं।
असमांगी मिश्रण
मिश्रण जिनके अवयवों को नंगी आँखों से देखा जा सकता है, असमांगी मिश्रण या विषमांगी मिश्रण कहलाते हैं। असमांगी मिश्रण के संघटन तथा गुण एक समान नहीं होते हैं। असमांगी मिश्रण या विषमांगी मिश्रण को अंग्रेजी में हेट्रोजिनियस मिक्चर कहते हैं।
"हेट्रोजिनियस" ग्रीस (Greek) के दो शब्दों "हेट्रो(Heteros)" तथा "जिनस (genos)" से मिलकर बना है। इसमें "हेटेरोस (Heteros)" का अर्थ होता है "अलग (different)" तथा "जिनस (genos)" का अर्थ है "जाति, प्रकार या किस्म"। अर्थात "अलग अलग प्रकार की किस्म या अलग अलग प्रकार की जाति का"।
उदाहरण
तेल तथा जल का मिश्रण, रेत तथा चीनी का मिश्रण, धुँआ तथा हवा का मिश्रण, आदि।
विलायक तथा विलेय
विलायक
विलयन में सामान्यत: जो अवयव अधिक मात्रा में उपस्थित होता है, विलायक कहलाता है। विलायक विलयन की भौतिक अवस्था निर्धारित करता है, जिसमें विलयन विद्यमान होता है। विलायक को अंग्रेजी में "शाल्वेंट (Solvent)" कहा जाता है।
विलेय
विलयन में जो अवयव कम मात्रा में उपस्थित रहता है, विलेय कहलाता है। किसी भी विलयन में विलेय एक या एक से अधिक हो सकता है।
दूसरे शब्दों में विलयन में विलायक के अतिरिक्त उपस्थित एक या अधिक अवयव विलेय कहलाते हैं। विलेय को अंग्रेजी में "शॉल्यूट (Solute)" कहा जाता है।
उदाहरण
चीनी तथा जल के विलयन में चीनी की मात्रा कम तथा जल की मात्रा अधिक होती है। अत: चीनी तथा जल के विलयन में चीनी विलेय तथा जल विलायक है।
द्विअंगी विलयन
विलयन जिसमें केवल दो अवयव उपस्थित हों, द्विअंगी विलयन कहलाता है। जैसे नमक तथा जल का विलयन, सिरके तथा जल का विलयन, ऑक्सीजन तथा नाइट्रोजन का विलयन, आदि।
द्विअंगी विलयन को अंग्रेजी में "बाइनरी शॉल्यूशन (Binary Solution)" कहा जाता है।
विलयनों के प्रकार
विलयन के घटक या अवयव ठोस, द्रव या गैस हो सकते हैं। विलयन को उनके अवयवों के आधार पर निम्नांकित तीन प्रकार में बाँटा जा सकता है:
(1) गैसीय विलयन
(2) द्रव विलयन तथा
(3) ठोस विलयन
(1) गैसीय विलयन
विलयन जिसमें विलायक गैसीय अवस्था में होता है, को गैसीय विलयन कहा जाता है। गैसीय विलयन को तीन प्रकार में बाँटा जा सकता है।
(क) गैस–गैस विलयन
गैसीय विलयन जिसमें विलेय तथा विलायक दोनो गैसीय अवस्था में हों, को गैस–गैस विलयन कहा जाता है। जैसे, ऑक्सीजन तथा नाइट्रोजन गैस का मिश्रण, ऑक्सीजन तथा कार्बन डाइऑक्साइड गैस का विलयन, आदि।
(ख) द्रव–गैस विलयन
गैसीय विलयन जिसमें विलेय द्रव अवस्था में तथा विलायक गैसीय अवस्था में हों, को द्रव–गैस विलयन कहा जाता है। जैसे, क्लोरोफॉर्म और नाइट्रोजन गैस का विलयन, इसमें क्लोरोफॉर्म विलेय तथा नाइट्रोजन गैस विलायक है।
(ग) ठोस–गैस विलयन
गैसीय विलयन जिसमें विलेय ठोस अवस्था में तथा विलायक गैसीय अवस्था में हों, को द्रव–गैस विलयन कहा जाता है। जैसे, कपूर का नाइट्रोजन गैस में विलयन।
(2) द्रव विलयन
विलयन जिसमें विलायक द्रव अवस्था में होता है, को द्रव विलयन कहा जाता है। द्रव विलयन विलेय के अनुसार पुन: तीन भागों में बाँटा जा सकता है।
(क) गैस–द्रव विलयन
गैसीय विलयन जिसमें विलेय गैस अवस्था में तथा विलायक द्रव अवस्था में हों, को गैस–द्रव विलयन कहा जाता है। जैसे जल में ऑक्सीजन का विलयन।
(ख) ठोस–द्रव विलयन
गैसीय विलयन जिसमें विलेय ठोस अवस्था में तथा विलायक द्रव अवस्था में हों, को ठोस–द्रव विलयन कहा जाता है। जैसे चीनी तथा जल का विलयन।
(ग) द्रव–द्रव विलयन
गैसीय विलयन जिसमें विलेय तथा विलायक दोनों द्रव अवस्था में हों, को द्रव–द्रव विलयन कहा जाता है। जैसे सिरका तथा जल का विलयन।
(3) ठोस विलयन
विलयन जिसमें विलायक ठोस अवस्था में हो, को ठोस विलयन कहा जाता है। ठोस विलयन विलेय की अवस्था के अनुसार तीन प्रकार के होते हैं।
(क) ठोस–ठोस विलयन
विलयन जिसमें विलेय तथा विलायक दोनों ठोस अवस्था में हों, को ठोस–ठोस विलयन कहा जाता है। जैसे, ताम्बा तथा सोना का विलयन, जिंक तथा लोहे का विलयन, आदि।
(ख) गैस–ठोस विलयन
विलयन जिसमें विलेय गैसीय अवस्था में तथा विलायक ठोस अवस्था में हो, को गैस–ठोस विलयन कहा जाता है। जैसे हाइड्रोजन का पैलेडियम में विलयन।
(ग) द्रव–ठोस विलयन
विलयन जिसमें विलेय द्रव अवस्था में तथा विलायक ठोस अवस्था में हो, को द्रव–ठोस विलयन कहा जाता है। जैसे पारा तथा सोडियम का विलयन इसे अमेलगम भी कहा जाता है।
विलयन के प्रकार |
|||
|---|---|---|---|
| विलयन का नाम | विलेय | विलायक | विलयन का उदारण |
| (1) गैसीय विलयन | गैस | गैस | ऑक्सीजन तथा नाइट्रोजन गैस का मिश्रण |
| द्रव | गैस | क्लोरोफॉर्म का नाइट्रोजन गैस में विलयन | |
| ठोस | गैस | कपूर का नाइट्रोजन गैस में विलयन | |
| (2) द्रव विलयन | गैस | द्रव | जल में ऑक्सीजन का विलयन |
| द्रव | द्रव | नींबू के रस का जल में विलयन | |
| ठोस | द्रव | नमक का जल में विलयन | |
| (3) ठोस विलयन | गैस | ठोस | हाइड्रोजन का पैलेडियम में विलयन |
| द्रव | ठोस | पारा का सोडियम के साथ विलयन | |
| ठोस | ठोस | ताम्बा तथा सोने का विलयन | |
विलयन की सान्द्रता को व्यक्त करना
सांन्द्रता क्या है? सान्द्रता की परिभाषा
विलयन की इकाई आयतन में उपस्थित विलेय की मात्रा विलयन की सान्द्रता कहलाती है। किसी विलयन के संघटन को सान्द्रता के द्वारा व्यक्त किया जाता है। सान्द्रता को गुणात्मक तथा मात्रात्मक दोनों तरह से व्यक्त किया जाता है।
विलयन के सान्द्रता को गुणात्ममक रूप से व्यक्त किया जाना
जब कहा जाता है कि यह विलयन सान्द्र है, तो इसका अर्थ यह होता है कि विलयन में विलेय की मात्रा अधिक है।
यदि यह कहा जाता है कि विलयन अत्यधिक सान्द्र है तो इसका अर्थ होता है कि विलयन में विलेय की मात्रा बहुत अधिक है।
जब कहा जाता है कि विलयन तनु है, तो इसका अर्थ यह होता है कि विलयन में विलेय की मात्रा अपेक्षाकृत बहुत कम है।
परंतु विलयन की सान्द्रता को इस तरह अर्थात गुणात्मक रूप से व्यक्त करने पर भ्रम की स्थिति उत्पन्न होती है, तथा सही सही यह पता नहीं चलता की विलयन कितना सान्द्र या कितना तनु है या विलयन की सान्द्रता कितनी है। बल्कि गुणात्मक रूप से सान्द्रता को व्यक्त करने पर केवल विलयन के संघटन का अनुमान लगाया जा सकता है।
अत: विलयन की सान्द्रता को मात्रात्मक रूप से व्यक्त किया जाता आवश्यक हो जाता है।
विलयन की सान्द्रता को मात्रात्मक रूप से व्यक्त किया जाना
मात्रात्मक रूप से विलयन की सान्द्रता को पाँच तरह से परिभाषित किया जा सकता है।
(क) द्रव्यमान प्रतिशत (w/w)
विलयन की सान्द्रता द्रव्यमान प्रतिशत (w/w) के रूप में निम्न तरह से परिभाषित किया जा सकता है।
विलयन के अवयव का द्रव्यमान प्रतिशत (%) 
अत: विलयन के कुल द्रव्यमान में उपस्थित विलयन के द्रव्यमान का प्रतिशत विलयन के अवयव का द्रव्यमान प्रतिशत (%) कहलाता है।
उदाहरण
(1) यदि एक 100 ग्राम विलयन में चीनी की मात्रा 20 ग्राम तथा जल की मात्रा 80 ग्राम है, तो इस विलयन की सान्द्रता को जल मे 20% द्रव्यमान के रूप में व्यक्त या परिभाषित किया जाता है।
(2) यदि एक 1000 ग्राम विलयन में ग्लूकोज की मात्रा 100 ग्राम तथा जल की मात्रा 900 ग्राम है, तो इस विलयन की द्रव्यमान प्रतिशत सान्द्रता 10% होगी।
(ख) आयतन प्रतिशत (V/V)
विलयन की सान्द्रता आयतन प्रतिशत (V/V) को निम्न प्रकार से परिभाषित किया जाता है:
अवयव का प्रतिशत आयतन (V/V) 
एसिटिक एसिड का जल में 10% विलयन का अर्थ है, 100 एमएल विलयन में 10 एमएल एसिटिक एसिड है तथा 90 एमएल जल है।
द्रवीय विलयन की सान्द्रता को प्राय: आयतन प्रतिशत (आयतन/आयतन) में व्यक्ति या परिभाषित किया जाता है। जैसे वाहन में डाला जाने वाला कूलेंट (एक द्रवीय विलयन जो वाहन के ईंजन को ठंढ़ा रखता है) एथिलीन ग्लाइकॉल का जल में 35% (V/V) विलयन होता है। इस सान्द्रता पर हिमरोधील जल के हिमांक को 255.4 K (–17.5 0C) तक कम कर देता है।
(ग) द्रव्यमान आयतन प्रतिशत (w/V)
100 मिलीलीटर विलयन में घुले हुए विलेय का द्रव्यमान द्रव्यमान –आयतन प्रतिशत कहलाता है। विलयन की सान्द्रता द्रव्यमान आयतन प्रतिशत में इकाई (मात्रक) औषधियों तथा फार्मेसी में उपयोग में आती है।
(घ) पार्टस पर (प्रति) मिलियन (पी.पी.एम.)
जब विलेय की मात्रा अत्यंत सूक्ष्म होती है, तो विलयन की सान्द्रता को पार्ट्स प्रति मिलियन (ppm) में प्रदर्शित किया जाना उपयुक्त होता है।
पार्ट्स पर (प्रति) मिलियन 
प्रतिशत की तरह ही पार्ट्स पर मिलियन (ppm) सान्द्रता को भी द्रव्यमान – द्रव्यमान, आयतन – आयतन तथा द्रव्यमान – आयतन में प्रदर्शित किया जा सकता है।
जल अथवा वायुमंडल में प्रदूषकों की सान्द्रता को प्राय: μ g mL–1 अथवा ppm में व्यक्त किया जाता है।
(च) मोल–अंश (मोल फ्रैक्शन)
अवयव का मोल अंश 
उदाहरण के लिए एक द्विअंगी विलयन (बाइनरी शॉल्यूशन) में यदि A तथा B अवयवों के मोल क्रमश: nA और nB हों, तो A का मोल–अंश (मोल फ्रैक्शन) होगा
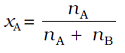
i अवयवों वाले विलयन में
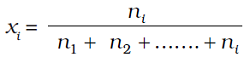
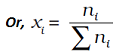
यह दर्शाया जा सकता है कि दिये गये विलयन में उपस्थित सभी अवयवों के मोल अंश का योग एक होता है, अर्थात
x1 + x2 + . . . + xi = 1
मोल अंश इकाई, विलयनों के भौतिक गुणों में संबंध दर्शाने में बहुत उपयोगी है जैसे विलयनों की सान्द्रता का वाष्पदाब के साथ संबंध दर्शाने में तथा इसका उपयोग गैसीय मिश्रणों के लिये आवश्यक गणना की ब्याख्या करने में भी है।
(छ) मोलरता
एक विलयन (1 क्यूबिक डेसीमीटर) विलयन में घुले हुए विलेय के मोलों की संख्या को उस विलयन की मोलरता (M) कहा जाता है। मोलरता को प्राय: अंग्रेजी के अक्षर M से दर्शाया जाता है।
मोलरता 
उदाहरण के लिए NaOH के 0.25 mol L–1 (0.25 M) विलयन का अर्थ है कि NaOH के 0.25 मोल को 1 लीटर (एक क्यूबिक डेसीमीटर) विलयन में घोला गया है।
(ज) मोललता
किसी विलयन की मोललता (m) 1 kg विलायक में उपस्थित विलेय के मोलों की संख्या के रूप में परिभाषित की जाती है। अर्थात
मोललता (m) 
उदारहण के लिए 1.00 mol kg–1 (1.00 m) KCl का जलीय विलयन का अर्थ है कि 1 mol (74.5 g) KCl को 1 kg जल में घोला गया है।
द्रव्यमान प्रतिशत, ppm, मोल अंश तथा मोललता ताप पर निर्भर नहीं करते हैं, जबकि मोलरता ताप पर निर्भर करती है। ऐसा इसलिये होता है कि आयतन ताप पर निर्भर करता है जबकि द्रव्यमान नहीं।
Reference: