विलयन
ठोस तथा गैस की द्रवों में विलेयता
विलेयता
एक विलायक की निश्चित मात्रा में घुली हुई किसी अवयव (पदार्थ) की अधिकतम मात्रा उस पदार्थ की विलेयता कहलाती है।
विलेयता विलेय एवं विलायक की प्रकृति तथा ताप एवं दाब पर निर्भर करती है।
उदारण: यदि सामान्य ताप पर 100 ग्राम जल में चीनी की अधिकतम 25 ग्राम घुल सकती है, तो चीनी की विलेयता 100 ग्राम जल में 25 ग्राम हुई।
ठोसों की द्रवों में विलेयता
किसी दिये गये द्रव में सभी ठोस नहीं घुलता है।
जैसे चीनी तथा नमक (सोडियम क्लोराइड) जल में आसानी से घुल जाता है लेकिन बेंजीन में नहीं घुलता है। तथा नैफ्थैलीन और एन्थ्रासीन बेंजीन में आसानी से घुल जाता है जबकि जल में नहीं घुलता है।
समान समान को घोलता है (like dissolves like)
यह देखा गया है कि ध्रुवीय विलेय, ध्रुवीय विलायकों में घुलते हैं जबकि अध्रुवीय विलेय अध्रुवीय विलायकों में।
सामान्यत: एक विलेय विलायक में घुल जाता है, यदि दोनों में अंतराण्विक अन्योन्यक्रियाएं समान हों। अत: यह कहा जाता है कि समान समान को घोलता है।
विलीनीकरण (डिसॉल्यूशन)
जब एक ठोस विलेय को द्रवीय विलायक में डाला जाता है, तो यह उसमें घुलने लगता है। यह प्रक्रिया विलीनीकरण (घुलना) कहलाती है।
दूसरे शब्दों में किसी ठोस विलेय की एक द्रव विलायक में घुलने की प्रक्रिया विलीनीकरण कहलाती है। विलीनीकरण को अंग्रेजी में डिसाल्यूशन कहते हैं।
क्रिस्टलीकरण (क्रिस्टलाइजेशन)
विलीनीकरण के क्रम में जब एक ठोस विलेय को द्रवीय विलायक में डाला जाता है, तो ठोस घुलने लगता है जिससे विलयन में विलेय की सान्द्रता बढ़ने लगती है। इसी समय विलयन में से विलेय के कुछ कण ठोस विलेय के कणों के साथ जुड़कर अलग हो जाते हैं। यह प्रक्रिया क्रिस्टलीकरण (Crystalization) कहलाती है।
अत: ठोस विलेय के द्रवीय विलयन में घुलनीकरण के क्रम में विलेय के कुछ कणों का ठोस विलेय के कणों के अलग होकर जुड़ने के प्रक्रिया क्रिस्टलीकरण कहलाती है।
गतिक साम्य (डायनेमिक इक्वीलिविरियम)
विलनीकरण के क्रम में विलेय के कुछ कणों का ठोस विलेय के कणों के साथ जुड़कर अलग हो जाने तथा ठोस के द्रवीय विलयन में घुलने की प्रक्रियाओं की गति समान हो जाती है। इस परिस्थिति में विलयन में जाने वाले विलेय कणों की संख्या विलयन से पृथक्कारी विलेय की संख्या के बराबर होगी, इस स्थिति को गतिक साम्य की प्रावस्था कहा जाता है।
गतिक साम्य की प्रावस्था में दिये गये ताप एवं दाब पर विलयन में उपस्थित विलेय की सान्द्रता स्थिर रहती है।
विलेय + विलायक ⇄ विलयन (गतिक साम्य प्रावस्था)
संतृप्त विलयन (सैचुरेटेड शॉल्यूशन)
(1) दिये गये ताप एवं दाब पर जब किसी विलयन में विलेय की और अधिक मात्रा नहीं घोली जा सके, तो ऐसा विलयन संतृप्त विलयन कहलाता है।
(2) वह विलयन जो बिना घुले विलेय के साथ गतिक साम्य में होता है, संतृप्त विलयन कहलाता है।
संतृप्त विलयन में विलायक की दी गई मात्रा में घुली हुई, विलेय की अधिकत मात्रा होती है। संतृप्त विलयन में विलेय की सान्द्रता उसकी विलेयता कहलाती है।
असंतृप्त विलयन
दिये गये ताप एवं दाब पर जब किसी विलयन में विलेय की और अधिक मात्रा घोली जा सके, तो ऐसा विलयन असंतृप्त विलयन कहलाता है।
विलेयता पर ताप का प्रभाव
सामान्यत: उष्माशोषी (एंडोथर्मिक) घुलने की प्रक्रिया में ताप बढ़ने से विलेयता बढ़ती है तथा ताप घटने से विलेयता कम होती है।
तथा यदि घुलने की प्रक्रिया उष्माक्षेपी (एक्सोथर्मिक) हो, तो ताप बढ़ने से विलेयता घटती है तथा ताप कम होने से विलेयता बढ़ती है।
विलेयता पर दाब का प्रभाव
ठोसों की द्रवों में विलेयता पर दाब का कोई प्रभाव नहीं पड़ता है। क्योंकि ठोस तथा द्रव अत्यधिक असंपीड्य (इनकम्प्रेशिबल) होते हैं तथा दाब में परिवर्तन से सामान्यत: अप्रभावित रहते हैं।
गैसों की द्रवों में विलेयता
बहुत सारे गैस जल में घुल जाते हैं। जैसे कि ऑक्सीजन जल में घुला रहता है। यह जल में घुली हुई ऑक्सीजन ही है जिसके कारण जल में रहने वाले जीव श्वास ले पाते हैं तथा जीवित रहते हैं।
गैस की द्रव में घुलनशीलता पर दाब का प्रभाव
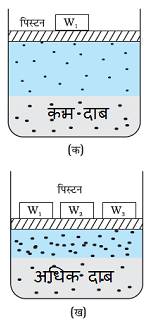
दाब बढ़ने पर गैस की द्रव घुलनशीलता बढ़ जाती है तथा दाब के कम होने पर गैस की द्रव में घुलनशीलता कम होती है।
ब्याख्या
चूँकि गैस अत्यधिक संपीड्य होते हैं, अत: दाब के बढ़ने पर प्रति एकांक आयतन में गैसों के अणुओं की संख्या बढ़ जाती है।
दाब बढ़ाने पर गैस की द्रव में घुलनशीलता तबतक बढ़ती जाती है जबतक की नयी गतिक साम्यावस्था प्राप्त नहीं हो जाती है।
अत: विलयन पर दाब बढ़ने पर गैस की विलायकता बढ़ती है।
उदाहरण: सॉफ्ट ड्रिंक में कार्बन डाइऑक्साइड को अधिक दाब पर घुलाया जाता है। अत: जब सॉफ्ट ड्रिंक के बोतल के ढ़क्कन को खोला जाता है तो कार्बन डाइऑक्साइड के निकलने के कारण हिस्स की आवाज आती है।
हेनरी का नियम
गैस की विलायक में विलेयता तथा दाब मे बीच मात्रात्मक संबंध सर्वप्रथम अंग्रेज रसायनशास्त्री [इंगलिश केमिस्ट (English Chemist)] हेनरी ने बतलाया। हेनरी द्वारा बतलाये गये संबंध को हेनरी का नियम कहते हैं।
हेनरी के नियम के अनुसार स्थिर ताप पर किसी गैस की द्रव में विलेयता गैस के दाब के समानुपाती होती है।
इस संबंध में जॉन डाल्टन, जो हेनरी के समकालीन थे, ने भी स्वतंत्र रूप से निष्कर्ष निकाला था कि किसी द्रवीय विलयन में गैस की विलेयता गैस के आंशिक दाब पर निर्भर करती है।
यदि विलयन में गैस के मोल अंश को उसकी विलेयता का माप मानें तो यह कहा जा सकता है कि किसी विलयन में गैस का मोल अंश उस विलयन के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होता है।
अत: सामान्य रूप से हेनरी के नियम के अनुसार किसी गैस का वाष्प अवस्था में आंशिक दाब (p), उस विलयन में गैस के मोल अंश (`x`) के समानुपाती होता है।
अथवा `p=K_Hx` - - - - - - - (i)
यहाँ `K_H` हेनरी स्थिरांक है तथा `p` आंशिक दाब एवं `x` मोल अंश है।
समीकरण (i) के अनुसार दिए गये दाब पर `K_H` का मान जितना अधिक होगा, द्रव में गैस की विलेयता उतनी ही कम होगी।
गैस के आंशिक दाब तथा विलयन में गैस के मोल अंश के बीच ग्राफ (आलेख)
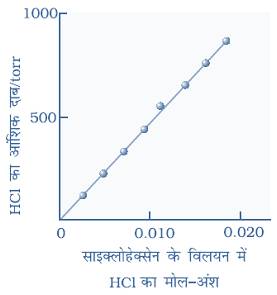
सामान्य ताप पर विभिन्न गैसों के लिए `K_H` का मान भिन्न भिन्न होता है, अर्थात `K_H` का मान गैस की प्रकृति पर निर्भर करता है।
| जल में कुछ गैसों के लिए हेनरी स्थिरांक (`K_H`) का मान | ||
|---|---|---|
| गैस | ताप/K | `K_H`/kbar |
| He | 293 | 144.97 |
| H2 | 293 | 69.16 |
| N2 | 293 | 76.48 |
| N2 | 303 | 88.84 |
| O2 | 293 | 34.86 |
| O2 | 303 | 46.82 |
| CO2 | 298 | 1.67 |
| आर्गन | 298 | 40.3 |
| फार्मल्डेहाइड | 298 | 1.83 × 10–5 |
| मिथेन | 298 | 0.413 |
गैसों की द्रव में विलेयता पर ताप का प्रभाव
ताप के बढ़ने पर द्रव में गैस की विलेयता कम होती है तथा ताप के कम होने पर द्रव में गैस की विलेयता बढ़ती है।
गैस को द्रव में घुलाना गैस को संघनन (कंडेशेसन) की तरह है। अर्थात गैस को द्रव में घुलाना एक उष्माक्षेपी (Exothermic) प्रक्रिया है, जिसमें उर्जा निकलती है। अत: ताप कम होने पर गैस की द्रव में विलेयता बढ़ेगी तथा ताप बढ़ने पर विलेयता कम होगी।
यही कारण है कि जलीय जीव अधिक ताप वाले जल की अपेक्षा कम ताप वाले जल में अधिक आराम (अच्छा) महसूस करते हैं।
हेनरी के नियम का उपयोग
(1) चूँकि दाब बढ़ने पर द्रव में गैस की विलेयता बढ़ती है इसलिए सोडा जल तथा शीतल पेय में CO2 की विलेयता बढ़ाने के लिए बोतल को अधिक दाब पर बंद किया जाता है।
(2) बेंड्स (Bends)
बेंड्स (Bends) एक चिकित्सीय अवस्था होती है जिसका सामना गोताखोरों को करना पड़ता है।
गहरे समुद्र में दबाब अधिक होता है जिसके कारण गैस की घुलनशीलता अधिक हो जाती है। अधिक बाहरी दाब पर श्वास के साथ ली गयी वायुमंडलीय गैसों की विलेयता खून में अधिक हो जाती है। जब गोताखोर सतह पर आते हैं और बाहरी दाब धीरे धीरे कम होने लगता है तो घुली हुई गैसें बाहर निकलने लगती हैं जिससे रक्त में नाइट्रोजन के बुलबुले बन जाते हैं। ये बुलबुले केशिकाओं में अवरोध उत्पन्न कर देते हैं जो काफी कष्टकारक तथा जानलेवा होता है। इस चिकित्सीय अवस्था को बेंड्स (Bends) कहते हैं।
बेंड्स (Bends) तथा नाइट्रोजन की रक्त में अधिक मात्रा के जहरीले प्रभाव से बचने के लिए गोताखोर के श्वास लेने वाले टैंक में हीलियम मिलाकर तनु (डायलूट) की गई हवा भरी जाती है। इस हवा में 11.7% हीलियम, 56.2% नाइट्रोजन तथा 32.1% ऑक्सीजन होती है।
(3) ऊँचाई बढ़ने पर हवा का दाब कम होने लगता है इसी कारण से अधिक ऊँची जगहों पर हवा का दबाव सतह वाले स्थान से कम ह होता है।
इसलिए ऊँची जगहों यथा पहाड़ों पर रहने वाले लोगों एवं पर्वतारोहियों के रक्त तथा टिशू (ऊतकों) में ऑक्सीजन की की सान्द्रता (concentration) कम हो जाती है जिससे वे कमजोर हो जाते हैं तथा सही सही नहीं सोच पाने के कारण भ्रम की स्थिति उत्पन्न हो जाती है। इस स्थिति को ऐनॉक्सिया कहते हैं।
Reference: