ठोस अवस्था
पदार्थ की अवस्थाएं एवं ठोस पदार्थों का वर्गीकरण
पदार्थ की तीन अवस्थाएं होती हैं: ठोस, द्रव और गैस।
निश्चित temperature (ताप) और pressure (दाब) पर किसी पदार्थ की कौन सी अवस्था अधिक स्थाई होगी यह दो विरोधी factors (कारकों) पर निर्भर करती है। ये factors (कारक) हैं – Intermolecular force (अंतराण्विक बल) तथा heat energy (उष्मीय उर्जा)।
पदार्थ का intermolecular force (अंतराण्विक उर्जा) पदार्थ के अणुओं, परमाणुओं अथवा आयनों को एक दूसरे की तरफ आकर्षित करती है, तथा उन्हें समीप रखने को प्रवृत रहती हैं। वहीं thermal energy (उष्मीय उर्जा) की प्रवृति पदार्थ के अणुओं, परमाणुओं अथवा आयनों को तीव्रगामी बनाकर पृथक रखने की होती है।
पदार्थ में पर्याप्त निम्न ताप पर उष्मीय उर्जा निम्न होती है इस स्थिति में Intermolecular force (अंतराण्विक बल) पदार्थ के अणुओं, परमाणुओं अथवा आयनों को इतना समीप कर देता है कि वे एक दूसरे के साथ cling (अनुलग्नित अर्थात जुड़) हो जाते हैं अर्थात जुड़ जाते है जिसके कारण पदार्थ के particles (कण) निश्चित स्थितियाँ ग्रहण कर लेते हैं तथा पदार्थ ठोस अवस्था में रहता है।
पदार्थ के ठोस अवस्था में भी उसके particles (कण) अपनी mean positions (माध्य स्थितियों) के चारों ओर oscillate (दोलन) करता है।
पदार्थ के ठोस अवस्था के अभिलाक्षणिक गुणधर्म (Characteristic properties of Solid State)
ठोस अवस्था में पदार्थ का निश्चित द्रव्यमान, आयतन एवं आकार होता है।
पदार्थ के particles (कणों) के की Intermolecular distance (अंतराण्विक दूरियाँ) काफी कम अर्थात लघु होती हैं।
पदार्थ के constituent particles (अवयवी कणों) यथा परमाणुओं, अणुओं अथवा आयनों की स्थितियाँ निश्चित होती हैं और ये particles केवल अपनी mean positions (माध्य स्थितियों) के चारों ओर oscillate (दोलन) कर सकते हैं।
ठोस पदार्थ incompressible (असंपीड्य) और rigid (कठोर) होते हैं।
ठोस पदार्थों का वर्गीकरण (Classification of solids)
ठोस पदार्थों को उनके particles (कणों) की व्यवस्था में उपस्थित क्रम की प्रकृति के आधार पर निम्नांकित दो भागों में बाँटा जा सकता है।
(1) अक्रिस्टलीय ठोस (Amorphous Solids)
(2) क्रिस्टलीय ठोस (Crystalline Solids)
क्रिस्टलीय ठोस (Crystalline Solids)
क्रिस्टलीय ठोस (crystalline solids) साधारणत: छोटे-छोटे (लघु (small)) क्रिस्टलों की अत्यधिक संख्यां (large number) से बना होता है।
क्रिस्टलीय ठोस के प्रत्येक लघु क्रिस्टलों का विशेष (अभिलाक्षणिक) geometrical shape (ज्यामितीय आकार) होता है।
क्रिस्टल में constituent particles (अवयवी कणों) का क्रम सुव्यवस्थित होता है।
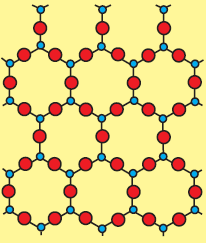
क्रिस्टल में दीर्घ परासी व्यवस्था (Long range order) होती है। अर्थात कणों की व्यवस्था का pattern नियमित होता है, तथा इस व्यवस्था की पुनरावृति संपूर्ण क्रिस्टल में एक से अंतराल पर होती है।
क्रिस्टलीय ठोस के उदारण: Sodium chloride (सोडियम क्लोराइड) तथा Quartz (क्वार्टज) crystalline solid के विशिष्ट उदाहरण हैं। सभी Metallic तथा Non-metallic solids यथा लोहा, सोना, चाँदी, ताम्बा, सल्फर, फास्फोरस, जिंक सल्फाइड, नैफ्थैलीन आदि क्रिस्टलीय ठोस हैं।
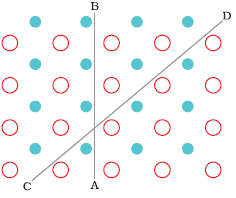
क्रिस्टलीय ठोस के गुण (Properties of Crystalline Solids)
क्रिस्टलीय ठोस का melting point (गलनांक) निश्चित होता है।
क्रिस्टलीय ठोस Anisotropic (विषमदैशिक) होते हैं। अर्थात उनके कुछ physical properties (भौतिक गुणों), यथा electrical resistance (विद्युत प्रतिरोधकता), refractive index (अपवर्तनांक), आदि भिन्न भिन्न दिशाओं में भिन्न भिन्न होते हैं। ऐसा भिन्न भिन्न दिशाओं में क्रिस्टलीय ठोस के अलग अलग व्यवस्था के कारण होता है।
क्रिस्टलीय ठोस को तेज धार वाले औजार से काटने पर इसके दो भागों में विभक्त टुकड़ों की सतहें सपाट तथा चिकनी होती हैं।
क्रिस्टलीय ठोस का heat of fusion ( गलन की उष्मा ) निश्चित तथा अभिलाक्षणिक होती है।
क्रिस्टलीय ठोस वास्तविक ठोस पदार्थ होते हैं।
अक्रिस्टलीय ठोस (Amorphous Solids)
अमोरफस एक ग्रीक शब्द है, जिसका अर्थ "आकृति नहीं होना" होता है। स्पष्टत: अक्रिस्टलीय ठोस (Amorphous solids) असमान आकृति वाले (असमाकृति (Irregular shape)) कणों से बने होते हैं।
अक्रिस्टलीय ठोस के अवयवी कणों (Constituent particles) (atoms, molecules or ions) की व्यवस्था केवल लघु परासी व्यवस्था (Short range order) होती है।
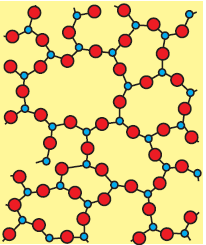
लघु परासी व्यवस्था (Short range order) में नियमित और आवृति पैटर्न केवल अल्प दूरियों तक ही देखा जाता है। अर्थात अक्रिस्टलीय ठोस के अवयवी कणों की नियमित तथा आवृति पैटर्न केवल अल्प दूरियों तक ही देखा जाता है। ऐसे भाग बिखरे होती हैं तथा इनके बीच व्यवस्था क्रम अनियमित होते हैं।
क्वार्टज काँच, रबर, प्लास्टिक, आदि अक्रिस्टलीय ठोस के कुछ विशिष्ट उदाहरण हैं।
क्रिस्टलीय ठोस तथा अक्रिस्टलीय ठोस के गुण उनके अवयवी कणों के व्यवस्था में अंतर के कारण भिन्न भिन्न होते हैं।
अक्रिस्टलीय ठोस (Amorphous solids) के गुण
Amorphous solid ताप के एक निश्चित परास (A range of temperature) पर नरम हो जाते है, इसी कारण Amorphous solid (अक्रिस्टलीय ठोस) को गलाकर साँचे में ढ़ाला जा सकता है, जैसे कि प्लास्टिक, काँच, आदि।
गर्म करने पर एक निश्चित ताप पर Amorphous solid क्रिस्टलीय बन जाते हैं। अक्रिस्टलीय ठोस के क्रिस्टलीय बन जाने के कारण ही प्राचीन सभ्यता की कुछ काँच के बने वस्तुओं में दुधियापन पाया जाता है।
अक्रिस्टलीय पदार्थ में तरल की भाँति प्रवाह प्रवृति होती है। हालाँकि अक्रिस्टलीय ठोस में प्रवाह की प्रवृति बहुत ही slow होती है। अक्रिस्टलीय पदार्थ के प्रवाह की प्रवृति के कारण ही बहुत पुराने इमारतों के खिड़कियों आदि में लगे काँच की जड़े ऊपर की अपेक्षा थोड़ा मोटे हो जाते हैं।
अक्रिस्टलीय ठोस की प्रकृति Isotropic (समदैशिक) होती है, क्योंकि उनमें दीर्घ परासी व्यवस्था (long range order) नहीं होती है, तथा सभी दिशाओं में irregular (अनियमित) arrangement (विन्यास) होता है।
अक्रिस्टलीय ठोस दैनिक जीवन में काफी उपयोगी हैं, यथा silicon, जो कि एक अक्रिस्टलीय ठोस है, सूर्य के प्रकाश के विद्युत रूपांतरण करने के लिए उपलब्ध श्रेष्टतम photovoltaic पदार्थ है।
| क्रिस्टलीय तथा अक्रिस्टलीय ठोस के गुणों में अंतर | |||
|---|---|---|---|
| गुण | क्रिस्टलीय ठोस | अक्रिस्टलीय ठोस | |
| आकार | निश्चित अभिलाक्षणिक आकार | असमाकृति आकार | |
| गलनांक (Melting point) | निश्चित और अभिलाक्षणिक ताप पर पिघलते हैं। | ताप के एक परास में धीरे-धीरे नरम पड़ते हैं। (Soften over a range of temperature) | |
| विदलन गुण (Cleavage property) | तेज धार वाले औजार से काटने पर प्राप्त टुकड़ों की सतहें सपाट और चिकनी होती हैं। | तेज धार वाले औजार से काटने पर प्राप्त टुकड़ों की सतहे अनियमित तथा रूखड़ी होती हैं। | |
| गलन की उष्मा (Heat of fusion) | गलन की उष्मा निश्चित और अभिलाक्षणिक होती है। | गलन की उष्मा निश्चित नहीं होती है। | |
| दैशिकता (Anisotropy) | विषमदैशिक (Anisotropic) प्रकृति के होते हैं। | समदैशिक (Isotropic) प्रकृति के होते हैं। | |
| अवयवी कणों की व्यवस्था में क्रम | दीर्घ परासी व्यवस्था (Long range order) | केवल लघु परासी व्यवस्था (Only short range order) | |
क्रिस्टलीय ठोसों का वर्गीकरण (Classification of Crystalline Solids)
क्रिस्टलीय ठोसों को उनमें परिचालित अंतराण्विक बलों (operating intermolecular forces) के आधार पर चार भागों में बाँटा जा सकता है। ये हैं: आण्विक ठोस (Molecular Solids), आयनिक ठोस (Ionic solids), धात्विक ठोस (Metallic solids) तथा सहसंयोजक ठोस (Covalent or Network solids)।(1) आण्विक ठोस (Molecular Solids)
वैसे क्रिस्टलीय ठोस जिनके अवयवी कण अणु (Molecule) होते हैं, को आण्विक ठोस (Molecular Solid) कहा जाता है। Molecular solids को पुन: तीन भागों में बाँटा जा सकता है। ये हैं: अध्रुवी आण्विक ठोस (Non-polar Molecular solids), ध्रुवीय आण्विक ठोस (Polar Molecular Solids), तथा हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded Molecular Solids)।
(क) अध्रुवी आण्विक ठोस (Non-polar Molecular solids)
परमाणुओं, यथा निम्न ताप पर आर्गन और हीलियम अथवा Non-polar bond से बने अणुओं, यथा निम्न ताप पर H2, Cl2 और I2 द्वारा बने ठोस को अध्रुवीय आण्विक ठोस कहा जाता है।
अध्रुवीय ठोस के परमाणु अथवा अणु Weak Dispersion Forces (दुर्बल परिक्षेपण बलों) या London Forces (लंडन बलों) द्वारा बँधे रहते हैं।
अध्रुवीय ठोस के गलनांक निम्न होते हैं तथा ये सामान्यत: कमरे के ताप और दाब पर द्रव अथवा गैसीय अवस्था में रहते हैं।
(ख) ध्रुवीय आण्विक ठोस (Polar Molecular Solids)
वैसे क्रिस्टलीय ठोस जिनके अणु अपेक्षाकृत प्रबल dipole-dipole interactions (द्विध्रुव-द्विध्रुव अन्योन्यक्रियाओं) द्वारा एक दूसरे से बंधे होते हैं, ध्रुवीय आण्विक ठोस (Polar Molecular Solids) कहलाते हैं। यथा HCl, SO2, SO2, NH3 आदि पदार्थ के अणु ध्रुवीय सहसंयोजक बंधों से बने होते हैं, अत: ये ध्रुवीय आण्विक ठोस कहलाते हैं।
ध्रुवीय आण्विक ठोस के melting point (गलनांक) अध्रुवीय आण्विक ठोस से अधिक होते हैं, फिर भी इनमें से अधिकतर कमरे के ताप और दाब पर गैस अथवा द्रव होते हैं।
(ग) हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded Molecular Solids)
ऐसे क्रिस्टलीय ठोस, जिनके अणुओं में H, और F, O अथवा N परमाणुओं के मध्य ध्रुवीय-सहसंयोजक बंध होते हैं, को हाइड्रोजन आबंधित आण्विक ठोस कहलाते हैं। ऐसे ठोस के अणुओं को प्रबल हाइड्रोजन आबंधन बंधित करते हैं, जैसे कि H2O (बर्फ)। हाइड्रोजन आबंधित आण्विक ठोस विद्युत के अचालक होते हैं। सामान्यत: यह कमरे के ताप और दाब पर वाष्पशील द्रव अथवा मुलायम ठोस होते हैं।
(2) आयनिक ठोस (Ionic Solids)
वैसे ठोस जिनके Constituent particles (अवयवी कण) आयन होते हैं, आयनिक ठोस (Ionic Solid) कहलाते हैं।
आयनिक ठोसों (Ionic Solids) का निर्माण positively charged ions [Anions (धनायनों)] तथा negatively charged ions [Cations (ऋणायनों)] के three dimensional (त्रिआयामी) विन्यासों में strong स्थिर वैद्युत (कूलॉमी) बलों से बंधने पर होता है।
आयनिक ठोस कठोर और भंगुर प्रकृति के होते हैं।
आयनिक ठोस के Melting point (गलनांक) और Boiling point (क्वथनांक) उच्च होते हैं। चूँकि आयनिक ठोस में आयन गमन के लिए स्वतंत्र नहीं होते हैं, अत: ये ठोस अवस्था में विद्युतरोधी होते हैं। आयनिक ठोस गलित अवस्था में अथवा जल में घोलने पर, आयन गमन के लिए मुक्त हो जाते हैं तथा वे विद्युत का संचालन करते हैं। अर्थात आयनिक ठोस, ठोस अवस्था में विद्युत के कुचालक तथा गलित अवस्था तथा जल के विलयन में विद्युत के सुचालक होते हैं।
(3) धात्विक ठोस (Metallic Solid)
धातु, धात्विक ठोस कहलाते हैं। धात्विक ठोस के अवयवी कण धनायन होते हैं। वास्तव में धातुएं मुक्त इलेक्ट्रॉन से धिरे और उनके द्वारा संलग्नित धनायनों का व्यवस्थित संग्रह हैं। ये इलेक्ट्रॉन निरंतर गतिशील होते हैं तथा क्रिस्टल में सर्वत्र समरूप से विस्तारित होते हैं।
धात्विक ठोस के ये मुक्त और गतिशील इलेक्ट्रॉन ही धातुओं की उच्च वैद्युत और उष्मीय चालकता के लिये उत्तरदायी होते हैं। जब धातुओं में विद्युत धारा प्रवाहित की जाती है, तो ये इलेक्ट्रॉन धनायनों के नेटवर्क में सतत प्रवाह करते हैं तथा विद्युत धारा प्रवाहित होने लगती है। उसी प्रकार धातु के एक भाग में उष्मा प्रदान की जाती है तो इसमें वर्तमान मुक्त तथा गतिशील इलेक्ट्रॉन उस उष्मीय उर्जा को धातु के पूरे भाग में समान रूप से विस्तारित कर देती है।
धातुओं की विशेष चमक भी उनमें उपस्थित मुक्त तथा गतिशील इलेक्ट्रॉन के कारण ही होती हैं। धातुएँ अत्यधिक अधातवर्धनीय (malleable) तथा तन्य (ductile) होती हैं।
(4) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Network Solids)
अधात्विक क्रिस्टलीय ठोस, जिनके संपूर्ण क्रिस्टल में निकटवर्ती परमाणुओं के बीच सहसंयोजक बंध बनने के कारण विस्तृत अनेकरूपता होती है, सहसंयोजक अथवा नेटवर्क ठोस कहलाते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) को Giant Molecule (विशाल अणु) भी कहा जाता है।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) के परमाणुओं के बीच सहसंयोजक बंध दिशात्मक (Directional) प्रकृति के होते हैं, इसलिये परमाणु अपनी स्थितिओं पर अति प्रबलता से संलग्न रहते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) के गुण
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) अति कठोर तथा भंगुर होते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का Melting point (गलनांक) काफी उच्च होता है तथा ये गलन से पूर्व विघटित भी हो सकते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) विद्युतरोधी होते हैं, अर्थात विद्युत का संचालन नहीं करते हैं।
Diamond (हीरा) तथा Silicon carbide (सिलिकॉन कार्बाइड) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का एक विशिष्ट उदाहरण है।
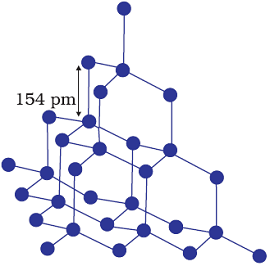
ग्रेफाइट भी सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का एक उदाहरण है, परंतु अपवाद स्वरूप ग्रेफाइट मुलायम तथा विद्युत का सुचालक है। ग्रेफाइट का यह अपवादी गुण उसकी विशिष्ट संरचना के कारण होता है।
| विभिन्न प्रकार के क्रिस्टलीय ठोस के गुण | ||||||
|---|---|---|---|---|---|---|
| ठोस के प्रकार | अवयवी कण | बंधन आकर्षण बल | उदारण | भौतिक प्रकृति | वैद्युत चालकता | गलनांक |
| (1) आण्विक ठोस | ||||||
| (i) अध्रुवी | अणु | परिक्षेपण अथवा लंडन बल | Ar, CCl4, H2, I2, CO2 | मुलायम | विद्युतरोधी | अत्यधिक निम्न |
| (ii)ध्रुवीय | अणु | द्विध्रुव-द्विध्रुव अन्योन्यक्रिया | HCl, SO2 | मुलायम | विद्युतरोधी | निम्न |
| (iii) हाइड्रोजन आबंधित | अणु | हाइड्रोजन आबंध | H2O (बर्फ) | कठोर | विद्युतरोधी | निम्न |
| (2) आयनिक ठोस | आयन | कूलॉमी अथवा स्थिर वैद्युत | NaCl, MgO, ZnS, CaF2 | कठोर परंतु भंगुर | ठोस अवस्था में विद्युतरोधी परंतु गलित अवस्था तथा जलीय विलयन में विद्युत चालक | उच्च |
| (3) धात्विक ठोस | विस्थानीकृत इलेक्ट्रॉन के समुद्र में धनायन | धात्विक आबंध | Fe, Cu, Ag, Mg | कठोर परंतु अघातवर्ध्य और तन्य | विद्युत चालक | साधारण उच्च |
| (4)सहसंयोजक अथवा नेटवर्क ठोस | परमाणु | सहसंयोजक आबंध | SiO2(क्वार्टज), SiC, C (हीरा), AlN, C(ग्रेफाइट) | कठोर, परंतु ग्रेफाइट मुलायम है (अपवाद) | विद्युतरोधी, परंतु ग्रेफाइट विद्युत का चालक है (अपवाद) | अत्यधिक उच्च |
Reference:
Images are taken from class twelve NCERT Chemistry part1 Book Chapter Solid State