ठोस अवस्था
संकुलन क्षमता
Packing Efficiency in Lattice
ठोसों के अवयवी कणों (atoms, molecules or ions) के किसी भी प्रकार संकुलित होने की स्थिति में भी कुछ स्थान रिक्त रह जाता है।
कुल उपलब्ध स्थान का वह प्रतिशत जो कणों द्वारा संपूरित होता है, संकुलन क्षमता (Packing Efficiency) कहलाता है।
hcp और ccp संरचनाओं में संकुलन क्षमता
hcp और ccp संरचनाओं में संकुलन क्षमता लगभग बराबर होती है।
मान लिया कि ccp संरचना के एकक कोष्ठिका के किनारे की लम्बाई `a` तथा फलक विकर्ण AC = b है।
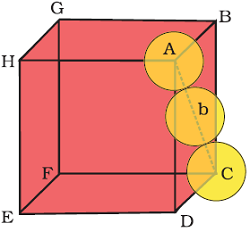
`triangle` ABC में,
`AC^2=BC^2 + AB^2`
`=>b^2 = a^2+a^2`
मान लिया कि यदि गोलो की त्रिज्या `= r` हो, तो `b=4r`
`:. b^2 =(4r)^2= 2a^2`
`=>4r = sqrt2 a`
`=>a = (4r)/sqrt2 = 2sqrt2 r` -----(i)
हम जानते हैं कि, `r` त्रिज्या वाले गोले का आयतन `=4/3 pi r^3`
चूँकि ccp संरचना में प्रति एकक कोष्ठिका 4 गोले होते हैं।
अत: 4 गोले का कुल आयतन `=4xx(4/3)pi r^3`
हम जानते हैं कि `a` किनारे वाले घन का आयतन `a^3`
अत: समीकरण (i) से `a` का मान रखने पर
एकक कोष्ठिका का कुल आयतन `=a^3 = (2sqrt2 r)^3`
अत: संकुलन क्षमता

`=(4xx(4//3)pi r^3xx100)/((2sqrt2 r)^3)% `
`=((16//3)pi r^3 xx100)/(16sqrt2 r^3)%`
अत: संकुलन क्षमता `=74%`
अंत: केन्द्रित घनीय संरचनाओं में संकुलन क्षमता (Packing Efficiency in Body Centered Cubic (bcc) Structures)
मान लिया अंत: केन्द्रित घनीय संरचना चित्र में ली गई है।
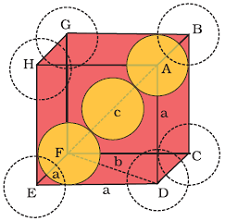
अंत: केन्द्रित घनीय संरचना में केन्द्र में अवस्थित परमाणु विकर्ण पर व्यवस्थित अन्य दो परमाणुओं के संपर्क में है।
मान लिया कि घनीय एकक की एक भुजा `=a` है।
तथा `triangle EFD` में विकर्ण `FD = b` है। `triangle AFD` में विकर्ण `AF = c` है। अत: `triangle EFD` में
`b^2 = a^2 + a^2 = 2a^2` -------- (ii)
`=>b = sqrt2 a`
अब, `triangle AFD` में,
`c^2 = a^2 + b^2`
`=>c^2 = a^2 + 2a^2`
[∵ `b^2=2a^2` समीकरण (ii) से]
`=>c^2 = 3a^2`
`=>c^2 = sqrt3 a` ---------(iii)
अब मान लिया कि परमाणु की त्रिज्या `=r`
अब चूँकि काय विकर्ण (diagonal) `c` की लंबाई एक पूरा गोला तथा दो आधा गोला के बराबर है।
अत: काय विकर्ण (diagonal) `c` की लंबाई =`4r`
अत: समीकरण (iii) में `c` का मान रखने पर हम पाते हैं कि
`4r = sqrt3 a`
`=> A = (4r)/sqrt3`
अब अंत: केन्द्रित घनीय (bcc) संरचना में परमाणुओं की कुल संख्या 2 है।
एक परमाणु (गोले) का आयतन `=(4//3)pi r^3`
अत: दो गोले का आयतन `=2xx(4//3)pi r^3`
हम जानते हैं कि घन का आयतन `a^3 = (4/sqrt3 r)^3`
अत: अंत: केन्द्रित घनीय संरचना में संकुलन क्षमता

`=(2xx(4//3)pi r^3xx100)/([(4//sqrt3)r]^3)%`
अत: अंत: केन्द्रित घनीय संरचना में संकुलन क्षमता `=68%`
सरल घनीय जालक में संकुलन क्षमता (Packing Efficiency in Simple Cubic Lattice)
एक सरल घनीय जालक की एकक कोष्ठिका चित्र में ली गई है।
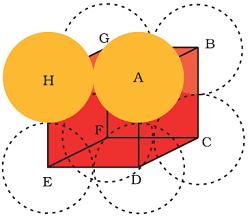
एक सरल घनीय जालक में केवल घन के कोनों पर परमाणु उपस्थित होते हैं।
मान लिया कि घन के एक भुजा की लम्बाई `=a` तथा प्रत्येक कण की त्रिज्या `r` है।
चूँकि घन के किनारों पर कण एक दूसरे के संपर्क में होते हैं,
अत: `a = 2r`
घनीय एकक कोष्ठिका का आयतन `=a^3=(2r)^3=8r^3`
चूँकि सरल घनीय एकक कोष्ठिका में केवल 1 परमाणु होता है। अत: परमाणु द्वारा भरे हुए स्थान का आयतन `=4/3 pr r^3`
अत: संकुलन क्षमता

`=(4//3 pi r^3)/(8r^3)xx100`
`=pi/6xx100`
`=52.36% = 52.4%`
अत:
(a) hcp और ccp संरचनाओं में संकुलन क्षमता (packing efficiency) = 74%
(b) अंत: केन्द्रित घनीय (bcc) संरचनाओं में संकुलन क्षमता (packing efficiency) = 68%
(c) तथा सरल घनीय जालक (simple cubic lattice) में संकुलन क्षमता (packing efficiency) = 52.4%
अर्थात hcp और ccp संरचनाओं में संकुलन क्षमता (packing efficiency) अधिकतम होती है।
एकक कोष्ठिका विमा संबंधी गणनाएं (Calculations involving Unit Cell Dimensions)
Unit cell के dimension की सहायता से यूनिट सेल का आयतन निकाला जा सकता है।
मान लिया कि Cubic crystal (घनीय क्रिस्टल) के Unit cell (एकक कोष्ठिका) के
कोर की लम्बाई `=a`
पदार्थ का घनत्व (Density) `=d` (पदार्थ तथा एकक कोष्ठिका का घनत्व बराबर होता है।)
तथा मोलर द्र्वयमान (Molar Mass) `=M` है।
अत: Cubic Crystal (घनीय क्रिस्टल) के
Unit cell (एकक कोष्ठिका) का आयतन `=a^3`
Unit cell (एकक कोष्ठिका) का द्र्व्यमान = एकक कोष्ठिका में परमाणु की संख्यां × एक परमाणु का द्रव्यमान
`= z * m`
(जहाँ `z =` एकक कोष्ठिका में उपस्थित परमाणुओं की संख्या
तथा `m=` एक परमाणु का द्रव्यमान)
एकक कोष्ठिका में उपस्थित एक परमाणु का द्रव्यमान
` m= M/N_A`
(जहाँ `M=` मोलर द्र्व्यमान तथा `N_A=` एवोगाड्रो संख्या है।)
अत: एकक कोष्ठिका का घनत्व, `d`

`=> d = (z*m)/a^3`
`=>d=(z*M)/(a^3*N_A)`
`=>d=(zM)/(d^3N_A)`
अत: उपरोक्त सूत्र के पाँच पैरामीटरों, d, z, M, a तथा NA, में से किसी चार के ज्ञात रहने पर पाँचवें की गणना उपरोक्त सूत्र से, की जा सकती है।
उदाहरण प्रश्न : 1. एक तत्व की कोष्ठिका की संरचना अंत: केन्द्रित घन (bcc) है। यदि कोष्ठिका के कोर की लंबाई 288 pm तथा तत्व का घनत्व 7.2 g/cm3 है, तो 308 ग्राम तत्व में कितने परमाणु हैं?
हल: दिया गया है,
एकक कोष्ठिका के कोर की लंबाई =288 pm
तत्व अर्थात एकक कोष्ठिका का घनत्व `=7.2 g//cm^3`
अत: 308 ग्राम तत्व में परमाणुओं की संख्या = ?
अत: एकक कोष्ठिका का आयतन =(288 pm)3
`=( 288xx10^(-12) m)^3`
`=(288xx10^(-10) cm)^3`
`=2.39 xx 10^(-23) cm^3`
अब तत्व का आयतन = द्रव्यमान / घनत्व
अत: 308 ग्राम तत्व का आयतन `= (308 g)/(7.2 g cm^3)`
`= 42.77 cm^3`
अत: इस आयतन में एकक कोष्ठिकाओं की संख्या
`=(42.77 cm^3)/(2.39xx10^(-23) cm^3)xx` एकक कोष्ठिका
`=17.89xx10^(23)` एकक कोष्ठिका
हम जानते हैं कि प्रत्येक bcc एकक कोष्ठिका में 2 परमाणु होते हैं।
अत: 308 ग्राम तत्व में परमाणुओं की संख्या
= 2 (परमाणु / एकक कोष्ठिका) `xx17.89xx10^23` एकक कोष्ठिका
`=35.78 xx 10^23` परमाणु उत्तर
यौगिक का सूत्र तथा संपूरित रिक्तियों की संख्या (Formula of a Compound and Number of Voids Filled)
जब ठोस के अवयव (कण) निविड संकुलित (close packed) होते हैं तो या तो ccp या hcp संरचनाएं बनती हैं। इस स्थिति में दो तरह की रिक्तियां (voids) उत्पन्न होती हैं: अष्टफलकीय रिक्तियाँ तथा चतुष्फलकीय रिक्तियां।
अष्टफलकीय रिक्तियों की संख्या Lattice (जालक) में निविड संकुलित कणों की संख्या के बराबर होती है जबकि चतुष्फलकीय रिक्तियों की संख्या निविड संकुलित संख्या के दोगुनी होती है।
Ionic Solid (आयनी ठोसों) में साधारणत: ऋणायन जो कि बृहत आयन होते हैं Close packed structure (निविड संकुलित संरचनाएं) बनाते हैं तथा धनायन जो कि लघुतर होते हैं, रिक्तियों में भरते हैं।
यदि धनायन पर्याप्त लघु होते हैं तो चतुष्फलकीय रिक्तियां और यदि वृहत होते हैं तो अष्टफलकीय रिक्तियां भरती (occupied) होती हैं।
इस स्थिति में भी सभी चतुष्फलकीय अथवा अष्टफलकीय रिक्तियाँ अध्यासित (occupied) नहीं होती है, बल्कि अध्यासित (Occupied) होने वाली रिक्तियां यौगिक के रासायनिक सूत्र पर निर्भर करता है।
उदाहरण: (1) एक यौगिक दो तत्वों `X` और `Y` से निर्मित है। `Y` तत्व के परमाणुओं (ऋणायन) ccp बनता है और `X` तत्व के परमाणु (धनायन) सभी अष्टफलकीय रिक्तियों में भरे होते हैं। इस स्थिति में यौगिक का सूत्र `XY` होता है।
ब्याख्या:
ccp Lattice (जालक), तत्व `Y` अर्थात ऋणायन से बनता है अत: अष्टफलकीय रिक्तियों की संख्या उसमे उपस्थित `Y` परमाणुओं की संख्या के बराबर होगी। चूँकि सभी अष्टफलकीय रिक्तियाँ तत्व `X` अर्थात धनायन से अध्यासित हैं, अत: `X` तथा `Y` परमाणुओं की संख्या बराबर होगी।
अर्थात `X` तथा `Y` परमाणुओं का अनुपात 1:1 होगा।
अत: इस यौगिक का सूत्र `XY` है।
उदाहरण: 2. तत्व B के परमाणुओं से hcp जालक बनता है और तत्व A के परमाणु 2/3 चतुष्फलकीय रिक्तियों को भरते हैं। इस स्थिति में इस यौगिक का सूत्र `A_4B_3` होगा।
ब्याख्या:
hcp जालक में बनने वाली रिक्तियों की संख्या तत्व B के परमाणुओं की संख्या के दोगुने के बराबर होगी।
यहाँ केवल 2/3 रिक्तियाँ ही तत्व A के परमाणुओं से अध्यासित है,
अत: A और B परमाणुओं की संख्यां का अनुपात `=2xx(2/3):1 = 4:3` होगा।
अर्थात यौगिक का सूत्र `A_4B_3` होगा।
Reference: