ठोस अवस्था
ठोसों में अपूर्णताएं
Imperfections in Solids
क्रिस्टलीय ठोस के अवयवी कणों की व्यवस्था के क्रम में अनियमितता होने के कारण क्रिस्टल परिपूर्ण नहीं होते हैं, तथा उसमें दोष उत्पन्न हो जाता है। ठोस में उत्पन्न दोषों को क्रिस्टल दोष या ठोस में अपूर्णता कहते हैं।
ठोस में उत्पन्न दोष व्यापक रूप से दो प्रकार के होते हैं, जिन्हें बिन्दु दोष (Point defects) तथा रेखीय दोष (Line defects) कहा जाता है।
(1) बिन्दु दोष (Point Defects)
एक क्रिस्टलीय पदार्थ में के बिन्दु अर्थात एक परमाणु के चारों ओर की आदर्श वयवस्था में अनियमितता अथवा विचलन होना बिन्दु दोष कहलाता है।
(2) रेखीय दोष (Line Defects)
एक क्रिस्टल पदार्थ जालक बिन्दुओं की पूर्ण पंक्तियों की आदर्श व्यवस्था में अनियमितताएं अथवा विचलन होने रेखीय दोष कहलाता है।
बिन्दु दोष के प्रकार (Types of Point Defects)
ठोसों के बिन्दु दोष को तीन प्रकार में वर्गीकृत किया जा सकता है:
(क) स्टॉइकियोमीट्री दोष (ख) अशुद्धता दोष और (ग) नॉनस्टॉइकियोमीट्री दोष
(क) स्टॉइकियोमीट्री दोष (Stoichiometric Defects):
ठोसों में वैसे बिन्दु दोष, जो ठोस की स्टॉइकियोमीट्री (Stoichiometry) को विक्षुब्ध (Disturb) या प्रभावित नहीं करते हैं, स्टॉइकियोमीट्री दोष (Stoichiometric Defects) कहलाता है। स्टॉइकियोमीट्री दोष को आंतर दोष (Intrinsic Defects) अथवा उष्मागतिकी दोष (Themodynamic defects) भी कहा जाता है।
स्टॉइकियोमीट्री दोष (Stoichiometric Defects) मुख्यत: दो प्रकार का होता है: (i) रिक्तिका दोष (Vacancy defect) और (ii) अंतरकाशी दोष (Interstitial Defect)
(i) रिक्तिका दोष (Vacancy defect)
जब कुछ जालक स्थल रिक्त हों, तो इसे क्रिस्टल में रिक्तिका दोष कहा जाता है। रिक्तिका दोष घनत्व को कम कर देता है। पदार्थ को गर्म करने पर भी इस प्रकार का रिक्तिका दोष उत्पन्न हो सकता है।
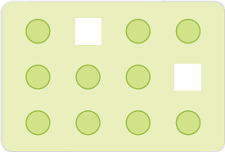
(ii) अंतरकाशी दोष (Interstitial Defect)
क्रिस्टल में कुछ अवयवी कण अंतरकाशी स्थल पर पाये जाने के कारण अवयवी कणों की व्यवस्था में होने वाली अनियमितता के कारण उत्पन्न दोष को अंतरकाशी दोष कहा जाता है।
अंतरकाशी दोष पदार्थ के घनत्व को बढ़ाता है।
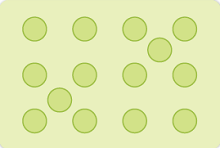
इस तरह के रिक्तिका तथा अंतरकाशी दोष अन आयनिक (non-ionic) ठोसों में दिखाई पड़ते हैं। आयनिक ठोस उदासीन होते हैं, अर्थात इनमें हमेशा उदासीनता बनी रहनी चाहिए।
यह इन दोषों को सरल रिक्तिका अथवा अंतरकाशी दोषों की बजाय, फ्रेंकेल और शॉटकी दोषों तरह दिखाते हैं।
(iii) फ्रेंकेल दोष (Frenkel Defect)
आयनिक ठोसों के क्रिस्टल में लघुतर आयन (साधारणत: धनायन) अपने वास्तविक स्थान से विस्थापित (displace) होकर अन्तराकाश स्थान (Interstitial site) में चला जाता है, तो उत्पन्न दोष को फ्रेंकेल दोष (Frenkel Defect) कहलाता है।
यह दोष आयनिक ठोस (Ionic solids) द्वारा दिखलाया जाता है।
फ्रेंकेल दोष (Frenkel Defect) वास्तविक स्थान पर रिक्तिका दोष (Vacancy defect) तथा नये स्थान पर अंतरकाशी दोष (Interstitial defect) उत्पन्न करता है।
फ्रेंकेल दोष को विस्थापन दोष (Dislocation Defect) भी कहा जाता है। फेंकेल दोष ठोस के घनत्व को प्रभावित नहीं करता है।

फ्रेंकेल दोष उन आयनिक पदार्थ द्वारा दिखलाया जाता है जिनमें आयनों के आकार में अधिक अंतर होता है।
उदाहरण : ZnS, AgCl, AgBr, AgI, इत्यादि। यह दोष `Zn^+` और `Ag^+` आयन के लघु आकार के कारण होता है।
(iv) शॉटकी दोष (Schottky Defect)
शॉटकी दोष (Schottky Defect) आधारभूत से आयनिक ठोसों का रिक्तिका दोष है। शॉटकी दोष (Schottky Defect) क्रिस्टलीकरण के क्रम में कुछ जालक स्थल के रिक्त हो जाने के कारण उत्पन्न होता है।
चूँकि आयनिक ठोसों को विध्युत उदासीनता बनाये रखना होता है, अत; लुप्त होने वाले धनायनों और ऋणायनों की संख्यां बराबर होती है।

चूँकि शॉटकी दोष (Schottky Defect) रिक्तिका दोष की तरह है, अत: यह भी पदार्थ के घनत्व को घटाता है।
शॉटकी दोष (Schottky Defect) उन आयनिक पदार्थों जिनमें धनायन तथा ऋणायन का आकार लगभग समान होते हैं, के द्वारा दिखलाया जाता है। जैसे कि: NaCl, KCl, CsCl और AgBr.
यहाँ `AgBr` द्वारा फ्रेंकेल तथा शॉटकी दोनों तरह का दोष दिखलाया जाता है।
(ख) अशुद्धता दोष (Impurity Defect)
जब गलित सोडियम क्लोराइड (NaCl) को `SrCl_2` (स्ट्रॉन्सियम क्लोराइड) की अल्प मात्रा के साथ क्रिस्टलीकृत किया जाता है, तो जालक में `Na^+` का कुछ स्थान `Sr^(++)` द्वारा घेर लिया जाता है अर्थात (प्रतिस्थापित) ऑक्यूपाइ कर लिया जाता है। इस स्थिति में प्रत्येक `Sr^(++)` (Strontium ion) द्वारा दो `Na^+` (सोडियम आयन) का स्थान प्रतिस्थापित किया जाता है। यह एक आयन का स्थान ग्रहण करता है और दूसरा स्थान रिक्त रह जाता है। इस प्रकार उत्पन्न धनायन रिक्तियों की संख्यां `Sr^(++)` (Strontium ion) के बराबर होती है।
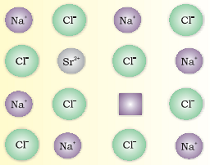
इस कारण से सोडियम क्लोराइड (NaCl) के क्रिस्टल में अशुद्धता आ जाती है। इस तरह की अशुद्धता के कारण उत्पन्न दोष को अशुद्धता दोष (Impurity Defect) कहा जाता है।
`CdCl_2` तथा `AgCl` का ठोस विलयन भी इस प्रकार के अशुद्धता दोष का उदाहरण है।
(ग) नॉन स्टॉइकियोमीट्री दोष (Non-Stoichiometric Defects)
वैसे नॉन स्टॉइकियोमीट्री अकार्बनिक ठोस जिनमें क्रिस्टल संरचनाओंमें दोष के कारण अवयवी नॉन स्टॉइकियोमीट्री अनुपात में पाये जाते हैं। ये दोष नॉन स्टॉइकियोमीट्री दोष (Non-Stoichiometric Defects) कहलाते हैं।
नॉन स्टॉइकियोमीट्री दोष (Non-Stoichiometric Defects) दो प्रकार के होते हैं: (i) धातु आधिक्य दोष तथा (ii) धातु न्यूनता दोष
(i) धातु आधिक्य दोष (Metal Excess Defect)
आयनिक ठोस धातु तथा अधातु के मिलने से बनता है। जब आयनिक ठोस के क्रिस्टल में धातु की संख्या अधिक हो जाती है, तो ठोस के अवयवी कणों की व्यवस्था में दोष आ जाता है। तथा इस तरह धातु की अधिकता के कारण उत्पन्न दोष को धातु आधिक्य दोष कहते हैं।
धातु आधिक्य दोष निम्नांकित दो कारणों से होता है: (i) ऋणायनिक रिक्तिका के कारण धातु आधिक्य दोष तथा (ii) अतिरिक्त धनायनों की अंतरकाशी स्थलों पर उपस्थिति से धातु आधिक्य दोष
(a) ऋणायनिक रिक्तिका के कारण धातु आधिक्य दोष (Metal excess defect due to anionic vacancies)
क्षारकीय हैलाइड (alkaline halides), जैसे NaCl और KCl इस प्रकार के दोष अर्थात ऋणायनिक रिक्तिका के कारण धातु आधिक्य दोष (Metal excess defect due to anionic vacancies) दर्शाते हैं।
जब NaCl के क्रिस्टल को वाष्प के वातावरण में गर्म किया जाता है, तो सोडियम परमाणु क्रिस्टल की सतह पर जम जाते हैं।
इस स्थिति में `Na^+` बनाने के लिये Na परमाणु एक इलेक्ट्रॉन निकल जाता है। इस तरह निर्मुक्त इलेक्ट्रॉन विसरित होकर क्रिस्टल के ऋणायनिक स्थान को अध्यासित (Occupy) कर लेते हैं। इससे Cl– आयन क्रिस्टल की सतह पर विसरित हो जाते हैं और Na परमाणुओं के साथ जुड़कर NaCl बना देते हैं।
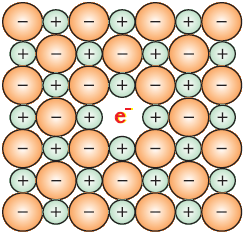
परिमाणस्वरूप क्रिस्टल में सोडियम का आधिक्य हो जाता है, अर्थात धातु का आधिक्य हो जाता है, जिसे धातु आधिक्य दोष कहा जाता है।
इस दोष के कारण उत्पन्न अयुग्मित इलेक्ट्रॉन द्वारा भरी ऋणायनिक रिक्तिकाओं को F–Center (F–केन्द्र) कहा जाता है। यहाँ अक्षर "F" जर्मन शब्द Farbenzenter (फारबेनजेनटर) से आया है, जिसका अर्थ रंग केन्द्र होता है।
ये अयुग्मित इलेक्ट्रॉन के NaCl के केन्द्र में होने के कारण क्रिस्टल को पीला रंग प्रदान करता है। यह रंग इलेक्ट्रॉन द्वारा क्रिस्टल पर पड़ने वाले प्रकाश से उर्जा अवशोषित करके उत्तेजित होने के कारण दिखता है।
इसी प्रकार का ऋणायनिक रिक्तिका के कारण धातु आधिक्य दोष होने के कारण लीथियम का आधिक्य LiCl क्रिस्टल को गुलाबी बनाता है। और पोटैशियम का आधिक्य KCl क्रिस्टल को बैंगनी बनाता है।
(b) अतिरिक्त धनायनों की अंतरकाशी स्थलों पर उपस्थिति से धातु आधिक्य दोष (Metal excess defect due to the presence of extra cations at interstitial sites)
जिंक ऑक्साइड इस तरह का दोष प्रदर्शित करता है। जिंक ऑक्साइड का रंग कमरे के तापमान पर सफेद होता है। गर्म करने पर जिंक ऑक्साइड पीले रंग का हो जाता है।
जब जिंक ऑक्साइड को गर्म किया जाता है, तो इसमें से ऑक्सीजन निकलता है।
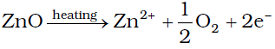
ऑक्सीजन के निकलने से जिंक ऑक्साइड के क्रिस्टल में जिंक का आधिक्य हो जाता है, तथा इसका सूत्र `Zn_(1+x)O` बन जाता है। आधिक्य में उपस्थित `Zn^(2+)` आयन अंतरकाशी स्थलों में, और इलेक्ट्रॉअन निकटवर्ती अंतरकाशी स्थलों में चले जाते है।
इस प्रकार धातु की अधिकता के कारण जिंक ऑक्साइड के क्रिस्टल में उत्पन्न दोष धातु आधिक्य दोष कहलाता है।
(ii) धातु न्यूनता दोष (Metal Deficiency Defect):
कई ऐसे ठोस हैं जिन्हें स्टॉइकियोमीट्री संघटन में बनाना कठिन होता है एवं इसमें समान्य अनुपात की तुलना में धातु की मात्रा कम होती है। अत: धातु के क्रिस्टल के ऐसे दोष जिसमें धातु का स्टॉइकियोमीट्री अनुपात की तुलना में धातु की मात्रा कम होती है, धातु न्यूनता दोष कहलाता है।
जैसे कि `FeO`
`FeO` अधिकतर `Fe_(0.95)O` संघटन में पाया जाता है। यह वास्तव में `Fe_(0.93)O` से `Fe(0.96)O` के रेंज (परास) में हो सकता है।
`FeO` के क्रिस्टल में से कुछ `Fe^(2+)` धनायन लुप्त हो जाते हैं और धनावेश की क्षतिपूर्ति `Fe^(3+)` आयनों की आवश्यक संख्या से होती है।
Reference: