धातु एवं अधातु - क्लास दसवीं विज्ञान
Back to 10th-science-home(Hindi)
Reaction of metals with solution of other metal salts
एक धातु अन्य धातुओं के लवण के साथ कैसे प्रतिक्रिया करता है?
जब एक ज्यादा प्रतिक्रियात्मक (Reactive) धातु (Metal) उससे कम प्रतिक्रियात्मक धातु के लवण (salt) के घोल साथ प्रतिक्रिया करता है, तो ज्यादा प्रतिक्रियात्मक धातु कम प्रतिक्रियात्मक धातु को उसके लवण (salt) से विस्थापित (displace) कर देता है।
M1 + M2B(aq) → M1B(aq) + M2
यहाँ M1 धातु, M2 धातु से ज्यादा प्रतिक्रियात्मक (More reactive) है। तथा M2B धातु M2 का लवण (salt) है।.
ऐसे प्रतिक्रिया को विस्थापन अभिक्रिया या विस्थापन प्रतिक्रिया (Displacement Reaction) कहते हैं।
उदाहरण:
आयरन (Iron) का कॉपर सल्फेट के घोल (Solution of Copper sulphate)के साथ प्रतिक्रिया
जब लोहे के कीलों (Iron nails) को कॉपर सल्फेट (Copper sulphate) के घोल में डुबाकर रखा जाता है तो लोहा कॉपर को विस्थापित (displace) कर देता है तथा आयरन सल्फेट (Iron sulphate) बनाता है।
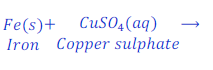
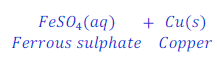
इस प्रतिक्रिया में आयरन (Iron) कॉपर (Copper) से अधिक प्रतिक्रियाशील (More reactive) है।
जिंक (Zinc) का कॉपर सल्फेट (Copper sulphate) के घोल के साथ प्रतिक्रिया
जब जिंक धातु (Zinc metal) कॉपर सल्फेट (Copper sulphate) के घोल के साथ प्रतिक्रिया करता है तो ज़िंक सल्फेट (Zinc sulphate) बनता है तथा कॉपर (Copper) मेटल अलग हो जाता है।
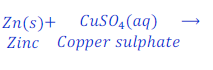
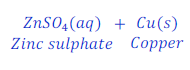
इस प्रतिक्रिया में जिंक (Zinc) के कॉपर मेटल (Copper metal) से ज्यादा प्रतिक्रियात्मक होने के कारण, जिंक (Zinc) कॉपर सल्फेट (Copper sulphate) के घोल से कॉपर को विस्थापित कर देता है।
कॉपर का सिल्वर नाईट्रेट (Silver nitrate) के घोल के साथ प्रतिक्रिया
जब कॉपर धातु सिल्वर नाईट्रेट (Silver nitrate) के धोल के साथ प्रतिक्रिया करता है तो कॉपर, सिल्वर को विस्थापित कर देता है तथा कॉपर नाईट्रेट (Copper nitrate) बनाता है।
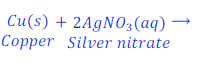
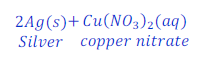
इस प्रतिक्रिया में कॉपर धातु सिल्वर (Silver) से ज्यादा प्रतिक्रियाशील है जिसके कारण कॉपर, सिल्वर नाईट्रेट (Silver nitrate) के घोल से सिल्वर को विस्थापित कर देता है।
सिल्वर धातु का कॉपर सल्फेट (Copper sulphate) के घोल के साथ प्रतिक्रिया
जब सिल्वर धातु को कॉपर सल्फेट (Copper sulphate) के धोल में डुबाकर रखा जाता है तो कोई प्रतिक्रिया नहीं होती है, क्योंकि सिल्वर, कॉपर से कम क्रियाशील है जिसके कारण सिल्वर कॉपर को कॉपर सल्फेट (Copper sulphate) के घोल से विस्थापित नहीं कर पाता है।
सिल्वर + कॉपर सल्फेट का घोल → कोई प्रतिक्रिया नहीं
सक्रियता श्रेणी (Reactivity Series)
सूची जिसमें धातुओं को उनके क्रियाशीलता (Reactivity) के आधार पर अवरोही क्रम (Descending order) में व्यवस्थित किया गया है, सक्रियता श्रेणी (Reactivity Series) कहलाती है। इस सूची में सबसे क्रियाशील धातु को सबसे उपर तथा सबसे कम क्रियाशील (Least reactive) धातु को सबसे नीचे रखा गया है।

सबसे ज्यादा क्रियाशील धातु बहुत तेजी से प्रतिक्रिया करता है जबकि सबसे कम क्रियाशील धातु या तो बिल्कुल ही प्रतिक्रिया नहीं करता है या विशेष परिस्थियों में ही प्रतिक्रिया करता है। जैसे कि पोटैशियम (Potassium) जो कि सक्रियता श्रेणी (Reactivity series) में सबसे उपर है सबसे ज्यादा तेजी से प्रतिक्रिया करता है जबकि सोना (Gold) तथा चाँदी (Silver) जो कि सक्रियता श्रेणी में सबसे नीचे है बिल्कुल ही प्रतिक्रिया नहीं करता है, सोने तथा चाँदी का यह भी एक गुण है जिसके कारण इन धातुओं का उपयोग जेवर बनाने में होता है।
अधातु (Non metal) के रासायनिक गुण (Chemical Properties):
अधातु (Non metal) का ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया
अधिकांश अधातु (Non metal) ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया कर संबंधित अधातुओं के ऑक्साईड (Respective metal oxides) बनाते हैं।
अधातु + ऑक्सीजन → अधातु के ऑक्साईड
अधातु के ऑक्साईड अम्लीय (Acidic) होते हैं। जब अधातु के ऑक्साईड (Non metal oxide) को पानी में घोला जाता है तो संबंधित अम्ल (Respective acid) बनता है।
उदाहरण:
कार्बन (Carbon) का ऑक्सीजन (oxygen) के साथ प्रतिक्रिया
कार्बन सामान्य तापमान पर ऑक्सीजन के साथ प्रतिक्रिया नहीं करते हैं। परंतु जब कार्बन को हवा में जलाया जाता है तो कार्बन डाईऑक्साईड (Carbon dioxide) गैस बनता है।

कार्बन को हवा में जलाना एक उष्माक्षेपी (Exothermic) प्रतिक्रिया है। यही कारण है कि कार्बन का उपयोग ईंधन के रूप में होता है। कोयला, पेट्रोल, प्राकृतिक गैस, इत्यादि कार्बन के विभिन्न रूप हैं।
कार्बन का कम ऑक्सीजन की उपस्थिति में दहन
जब कार्बन को कम ऑक्सीजन की उपस्थिति में जलाया जाता है, तो यह कार्बन मोनो ऑक्साईड (Carbon monoxide) बनाता है।

सल्फर (Sulphur) का ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया
सल्फर सामान्य तापमान पर ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया नहीं करता परंतु जब सल्फर को हवा में जलाया जाता है तो यह सल्फर डाईऑक्साईड (Sulphur dioxide) गैस देता है।
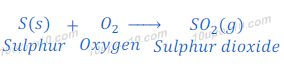
हाईड्रोजन (Hydrogen) का ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया
हाईड्रोजन (Hydrogen) ऑक्सीजन (Oxygen) के साथ प्रतिक्रिया कर जल बनाता है।
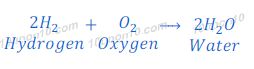
अधातु के ऑक्साईड के गुण (Properties of non metal oxides)
अधातु के ऑक्साईड (Non metal oxide) अम्लीय (acidic) होते हैं। अधातु के ऑक्साईड पानी से गीले ब्लू लिट्मस पत्र (Moist blue litmus paper) को लाल रंग में बदल देता है। जब अधातु के ऑक्साईड पानी में घुलकर अम्ल (Acid) बनाते हैं।
उदाहरण:
कार्बन डाईऑक्साईड (Carbon dioxide) का जल के साथ प्रतिक्रिया
जब कार्बन डाईऑक्साइड (Carbon dioxide) को पानी में घोला जाता है तो यह कार्बोनिक अम्ल (Carbonic acid) बनाता है। कार्बोनिक अम्ल (Carbonic acid) एक कमजोर अम्ल (Weak acid) है।
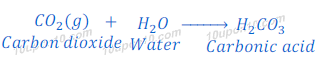
सल्फर डाईऑक्साईड (Sulphur dioxide) का जल के साथ प्रतिक्रिया
जब सल्फर डाईऑक्साइड (Sulphur dioxide) को पानी में घोला जाता है तो यह सल्फ्युरस अम्ल (Sulphurous acid) बनाता है।
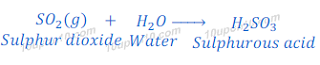
सल्फर डाईऑक्साइड (Sulphur dioxide) का ऑक्सीजन के साथ प्रतिक्रिया
सल्फर डाईऑक्साइड (Sulphur dioxide) ऑक्सीजन के साथ प्रतिक्रिया कर सल्फर ट्राई ऑक्साइड (Sulphur trioxide) बनाता है।
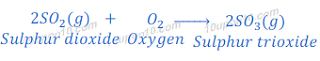
सल्फर ट्राई ऑक्साइड (Sulphur trioxide) का जल के साथ प्रतिक्रिया
सल्फर ट्राई ऑक्साइड जल के साथ प्रतिक्रिया कर सल्फ्युरिक अम्ल (Sulphuric acid) बनाता है।
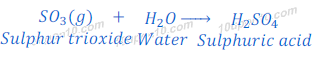
अम्लीय वर्षा (Acid Rain)
अम्लीय (Acidic) गुण वाले पानी का बारिश के रूप में पृथ्वी पर गिरना अम्लीय वर्षा (Acidic rain) कहलाती है। गाड़ियाँ, फैक्ट्रियाँ आदि से ईंधन के जलने के बाद कार्बन डाईऑक्साइड (Carbon dioxide) तथा सल्फर डाईऑक्साइड (Sulphur dioxide) धुँए के रूप में निकलती हैं, जो स्वास्थ्य तथा पर्यावरण के लिय काफी खतरनाक है। ये गैसें गाड़ियों तथा फैक्ट्रियों से निकलकर हवा में मिल जाती हैं तथा हवा में ही मौजूद रहती हैं।
जब बारिश होती है तो कार्बन डाईऑक्साइड (Carbon dioxide) तथा सल्फर डाईऑक्साइड (Sulphur dioxide) बारिश के पानी में घुलकर क्रमश: कार्बोनिक अम्ल (Carbonic acid) तथा सल्फ्युरिक अम्ल (Sulphuric acid) बनाती हैं जो कि बारिस की बून्दों के साथ पृथ्वी पर गिर जाती हैं।
बारिश की बून्दों के साथ कार्बोनिक अम्ल (Carbonic acid) तथा सल्फ्युरिक अम्ल (Sulphuric acid) का पृथ्वी पर गिरना अम्लीय वर्षा (Acid Rain) कहलाती है।
अम्लीय वर्षा ऐतिहासिक धरोहरों (Historical monuments) यथा ताजमहल, जो कि संगमरमर (Marble) का बना है, आदि के लिये काफी कतरनाक है। अम्लीय वर्षा इन ऐतिहासिक इमारतों (Historical buildings) को काफी क्षति पहुँचाती है। अम्लीय वर्षा जब नदियों, तालाबों के में मिलकर उनके पानी को आम्लिक (Acidic) बना देती है, नदियों तथा तालाबों के पानी के पी0एच0 का मान (Value of pH) अम्लीय पानी के मिलने के कारण कम हो जाता है तथा जलीय जीव मरने लगते हैं।
Reference: