धातु एवं अधातु - क्लास दसवीं विज्ञान
Back to 10th-science-home(Hindi)
Metals low in activity series
सक्रियता श्रेणी (Reactivity Series) के निचले हिस्से में आने वाले धातुओं का निष्कर्षण
सक्रियता श्रेणी (Reactivity Series) के निचले हिस्से में आने वाले धातु प्रकृति में मुक्त अवस्था में या सल्फाईड के रूप में पाये जाते हैं।
सल्फाईड (Sulphide) के रूप में पाये जाने वाले अयस्कों को सर्वप्रथम हवा की उपस्थिति में गर्म किया जाता है। सल्फाईड (Sulphide) अयस्क को हवा की उपस्थिति में गर्म किये जाने से, ये संबंधित धातु के ऑक्साईड में बदल जाता है तथा अयस्क में वर्तमान सल्फर, सल्फर डाईऑक्साईड गैस के रूप में अलग हो जाता है।
सल्फाईड (Sulphide) के रूप में पाये जाने वाले अयस्कों को सर्वप्रथम हवा की उपस्थिति में गर्म कर संबंधित ऑक्साईड (oxide) में बदले जाने की प्रक्रिया भर्जन (Roasting) कहलाती है।
उदहरण:
पारद का निष्कर्षण (Extraction of Mercury):
सिनाबार [Cinnabar (HgS)], जो कि पारद का अयस्क है, प्रकृति में पारद के सल्फाईड के रूप में पाया जाता है। सिनाबार [Cinnabar (HgS)] को सर्वप्रथम हवा की उपस्थिति में गर्म किया जाता है अर्थात सिनाबार [Cinnabar (HgS)] का सर्वप्रथम भर्जन (Roasting) किया जाता है। यह प्रक्रिया सिनाबार [Cinnabar (HgS)] को पारद के ऑक्साईड (Mercury oxide) में बदल देता है। तत्पश्चात पारद के ऑक्साईड (Mercury oxide) को पारद धातु (mercury metal) में अवकरित (Reduced) कर लिया जाता है।
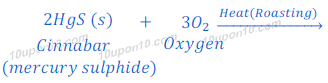
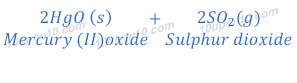
भर्जन (Roasting) के बाद प्राप्त mercury (II) oxide को पुन: गर्म किये जाने पर वह पारद धातु में बदल जाता है।

कॉपर का निष्कर्षण (Extraction of copper)
कॉपर प्रकृति में सल्फाईड के रूप में पाया जाता है। कॉपर का यह अयस्क को कॉपर ग्लांस [Copper glance (Cu2S)] कहते हैं। कॉपर ग्लांस [Copper glance (Cu2S)] को हवा की उपस्थिति में गर्म किया जाता है, जिससे कॉपर ग्लांस [Copper glance (Cu2S)] कॉपर ऑक्साईड [copper (I) oxide] में बदल जाता है।
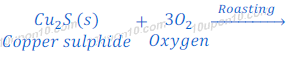
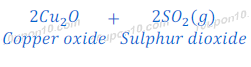
इस तरह प्राप्त कॉपर ऑक्साईड [copper (I) oxide] के अवकरण द्वारा कॉपर धातु प्राप्त कर लिया जाता है |

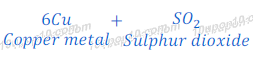
सक्रियता श्रेणी (Reactivity Series) के मध्य भाग में आने वाले धातुओं का निष्कर्षण (Extraction)
सक्रियता श्रेणी (Reactivity Series) के मध्य भाग में आने वाले धातु, उपरी भाग में आने वाले धातुओं से अपेक्षाकृत कम तथा निचले भाग में आने वाले धातुओं के ज्यादा प्रतिक्रियाशील होते हैं।
उदाहरण: आयरन (Iron), जिंक (zinc), लेड (lead), इत्यादि।
सक्रियता श्रेणी (Reactivity Series) के मध्य भाग में आने वाले धातु प्रकृति में संबंधित सल्फाईड तथा कार्बोनेट के रूप में पाया जाता है।
सल्फाईड अयस्क का भर्जन (Roasting of Sulphide ores)
सल्फाईड के रूप में पाये जाने वाले धातु के अयस्कों को सर्वप्रथम भर्जन (Roasting) की प्रक्रिया के द्वारा संबधित ऑक्साईड में बदला जाता है। भर्जन (Roasting) की प्रक्रिया में सल्फाईड अयस्क को हवा की उपस्थिति में गर्म किया जाता है, जिससे सल्फाईड अयस्क संबंधित धातु के ऑक्साईड में बदल जाता है।
कार्बोनेट के रूप में पाये जाने वाले अयस्क का निस्तापन (Calcination)
कार्बोनेट के रूप में पाये जाने वाले धातु के अयस्कों को सर्वप्रथम निस्तापन (Calcination) की प्रक्रिया के द्वारा संबधित ऑक्साईड में बदला जाता है। निस्तापन (Calcination) की प्रक्रिया में कार्बोनेट के रूप में पाये जाने वाले अयस्क को सीमित हवा की उपस्थिति में गर्म किया जाता है, जिससे कार्बोनेट के रूप में अयस्क संबंधित धातु के ऑक्साईड में बदल जाता है।
अवकरण् या उपचयन (Reduction)
भर्जन (Roasting) या निस्तापन (Calcination) के बाद प्राप्त धातु के ऑक्साईड उपयुक्त उपाचय के साथ मिलाकर गर्म किया जाता है, जिससे धातु के ऑक्साईड संबंधित धातु में अवकरित हो जाता है। इस प्रक्रिया को अवकरण् या उपचयन कहा जाता है।
उदाहरण:
जिंक धातु का निष्कर्षण (Extraction of Zinc metal)
जिंक धातु, प्रकृति में जिंक ब्लेंड [zinc blende [ZnS (Zinc sulphide)]] तथा [Calamine [Zn(CO)3(Zinc carbonate)]] के रूप में पाया जाता है।
जिंक धातु का जिंक ब्लेंड अयस्क (Zinc Blende Ore) से निष्कर्षण
जिंक ब्लेंड अयस्क (Zinc Blende Ore) का भर्जन (Roasting)
जिंक ब्लेंड [Zinc blende [ZnS (Zinc sulphide)]] को सर्वप्रथम भर्जन (Roasting) की प्रक्रिया के द्वारा जिंक ऑक्साईड में परिवर्तित किया जाता है। भर्जन (Roasting) की प्रक्रिया में जिंक ब्लेंड [Zinc blende [ZnS (Zinc sulphide)]] को हवा की उपस्थिति में काफी गर्म किया जाता है, इस प्रक्रिया में जिंक ब्लेंड (Zinc blende) जिंक ऑक्साईड (Zinc oxide) में बदल जाता है।
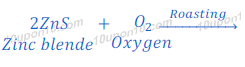
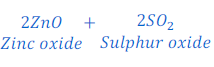
कैलामाईन अयस्क का निस्तापन (Calcination)
कैलामाईन अयस्क [Calamine [Zn(CO)3(Zinc carbonate)]] को सीमित हवा की उपस्थिति में गर्म किया जाता है। इस निस्तापन (Calcination) की प्रक्रिया में कैलामाईन अयस्क जिंक कार्बोनेट [zinc carbonate [Zn(CO)3]] में बदल जाता है।
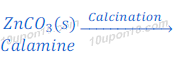
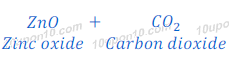
जिंक ऑक्साईड (Zinc oxide) से जिंक धातु प्राप्त करने के लिय अवकरण (Reduction)
भर्जन (Roasting) या निस्तापन (Calcination) के बाद प्राप्त जिंक ऑक्साईड [Zinc oxide(ZnO)] से अवकरण (Reduction) की विधि द्वारा जिंक (Zinc) धातु प्राप्त किया जाता है। इस प्रक्रिया में जिंक ऑक्साईड [Zinc oxide(ZnO)] को एक उपाचय (Reducing agent), यथा कार्बन (carbon) के साथ गर्म किया जाता है , जिससे जिंक ऑक्साईड [Zinc oxide(ZnO)] जिंक धातु (Zinc metal) में अवकरित (Reduced) हो जाता है।
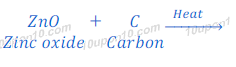
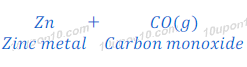
धातु के ऑक्साईड (metal oxide) का संबंधित धातु में कार्बन के अतिरिक्त (other than carbon) उपाचय (reducing agent) के उपयोग से अवकरण (Reduction)
कार्बन के अतिरिक्त भी कई उपाचयों (Reducing agent) का उपयोग धातु के ऑक्साईड (metal oxide) से संबंधित धातु प्राप्त करने के लिये किया जाता है। कई बार धातु के ऑक्साईड (metal oxide) से विस्थापन की प्रतिक्रिया (Displacement reaction) द्वारा संबंधित धातु प्राप्त किया जाता है। विस्थापन की प्रतिक्रिया (Displacement reaction) में ज्यादा अभिक्रियाशील (more reactive) धातु कम क्रियाशील (less reactive) धातु को उनके कम्पाउंड से विस्थापित (Displace) कर देता है। विस्थापन की प्रतिक्रियाओं में काफी प्रतिक्रियाशील (high reactive) धातु, जैसे कि सोडियम (Sodium), कैल्शियम (Calcium), अल्युमिनियम (Aluminium), आदि का उपयोग उपाचय (Reducing agent) के रूप में किया जाता है।
उदाहरण:
मैगनीज डाईऑक्साइड [Manganese dioxide (MnO2)] का मैगनीज (manganese) धातु में अवकरण (Reduction)
जब मैगनीज डाईऑक्साइड (magnese dioxide) को अल्युमिनियम (Aluminum) धातु के साथ गर्म किया जाता है, तो अल्युमिनियम (Aluminium), जो कि मैगनीज (Manganese) से ज्यादा क्रियाशील है, मैगनीज को मैगनीज डाईऑक्साइड (Manganese dioxide) से विस्थापित कर देता है तथा अल्युमिनियम ऑक्साईड (Aluminium oxide) बनाता है तथा मैगनीज धातु देता है।
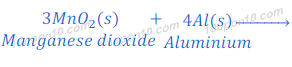

इस प्रतिक्रिया में मैगनीज डाईऑक्साइड (manganese dioxide) का अवकरण (Reduction) मैगनीज धातु में तथा अल्युमिनियम (Aluminium) धातु का ऑक्सीकरण (Oxidation) अल्युमिनियम ऑक्साईड (Aluminium oxide) में हो जाता है।
यह प्रतिक्रिया एक उच्च उष्माक्षेपी प्रतिक्रिया (highly exothermic reaction) है। इस तरह की प्रतिक्रिया में निकलने वाली उष्मा इतनी अधिक होती है कि धातु पिघली हुई अवस्था (molten state) में प्राप्त होती है।
थरमिट प्रतिक्रिया (Thermit Reaction)
जब फेरिक ऑक्साईड [ferric oxide [Iron (III) oxide]] को अल्युमिनियम (Aluminium) धातु के साथ गर्म किया जाता है, तो फेरिक ऑक्साईड [ferric oxide [Iron (III) oxide]] का अवकरण (Reduction) लोहा (Iron) में हो जाता है।


इस प्रतिक्रिया में आयरन (III) ऑक्साईड [Iron (III) oxide] का अवकरण (Reduction) लोहे (iron) में तथा अल्युमिनियम (Aluminium) का ऑक्सीकरण (oxidation) अल्युमिनियम ऑक्साईड (Aluminium oxide) में हो जाता है। इस प्रतिक्रिया में प्राप्त लोहा पिघली हुई अवस्था (molten state) में मिलती है।
इस प्रतिक्रिया को थरमिट प्रतिक्रिया (Thermit Reaction) कहा जाता है
थरमिट प्रतिक्रिया (Thermit Reaction) का उपयोग रेल लाईनों को जोड़ने तथा मशीन के पुर्जों की दरार को जोड़ने में किया जाता है।
कॉपर ऑक्साईड (Copper oxide) का अल्युमिनियम (Aluminium) के साथ अवकरण (Reduction)
कॉपर ऑक्साईड (Copper oxide) को जब अल्युमिनियम (Aluminium) के साथ गर्म किया जाता है, तो कॉपर ऑक्साईड (Copper oxide) का कॉपर धातु में अवकरण (Reduction) हो जाता है। इस प्रतिक्रिया में भी काफी ताप उर्जा निकलती है। यह प्रतिक्रिया एक उच्च उष्माक्षेपी प्रतिक्रिया (Highly exothermic reaction) है।
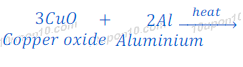
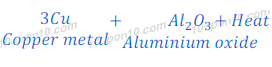
चूँकि इस प्रतिक्रिया में काफी ज्यादा उष्मा निकलती है अत: कॉपर ऑक्साईड (Copper oxide) का उपयोग आयरन ऑक्साईड (Iron oxide) की जगह पर थरमिट वेल्डिंग (Thermit welding), अर्थात रेल ट्रैक आदि को जोड़्ने में किया जाता है।
Reference: