धातु एवं अधातु - क्लास दसवीं विज्ञान
Back to 10th-science-home(Hindi)
Metals in top of the Activity series
सक्रियता श्रेणी (Reactivity Series) के उपरी भाग में आने वाले धातु का निष्कर्षण
सोडियम, मैग्निशियम, कैल्शियम, अल्युमिनियम आदि सक्रियता श्रेणी (Reactivity Series) के उपरी भाग में आते हैं। चूँकि ये धातु काफी अभिक्रियाशील हैं, अत: इनका निष्कर्षण अन्य धातुओं की तरह कार्बन का उपयोग उपाचय के रूप में कर अवकरण के द्वारा नहीं किया जा सकता है। क्योंकि सोडियम, मैग्निशियम, कैल्शियम, अल्युमिनियम आदि धातुएँ ऑक्सीजन के साथ कार्बन से ज्यादा तेजी से प्रतिक्रिया करती हैं, अर्थात इन धातुओं की बंधता ऑक्सीजन के साथ कार्बन से अधिक है।
अत: सक्रियता श्रेणी (Reactivity Series) के उपरी भाग में आने वाले धातुओं को विद्युत अपघट्नी उपचय द्वारा निष्कर्षण किया जाता है। जैसे कि सोडियम धातु का निष्कर्षण पिघली हुई सोडियम क्लोराईड के विद्युत अपघटन के द्वारा किया जाता है।
इस प्रक्रिया को विद्युत अपघट्नी उपचय कहा जाता है। इस प्रक्रिया में प्राप्त धातु बिल्कुल शुद्ध होते हैं।
उदाहरण:
सोडियम धातु का सोडियम क्लोराईड से निष्कर्षण
जब विद्युत धारा को पिघली हुई सोडियम क्लोराईड में प्रवाहित की जाती है तो, सोडियम आयन जो कि धनावेशित होते हैं, ॠणात्मक ध्रुव पर सोडियम मेटल के रूप में तथा क्लोराईड आयन जो कि ॠणावेशित होते हैं, धन ध्रुव पर क्लोरीन के रूप में प्राप्त होता है।

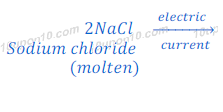
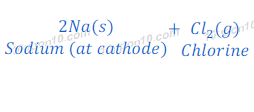
इस प्रक्रिया में केवल पिघली हुई सोडियम क्लोराईड का उपयोग होता है और सोडियम क्लोराईड के घोल का नहीं, क्योंकि जब सोडियम क्लोराईड के घोल में विद्युत धारा प्रवाहित की जाती है तो कैथोड पर प्राप्त होने वाला सोडियम मेटल पानी के साथ प्रतिक्रिया कर सोडियम हाईड्रोक्साईड बना देता है।
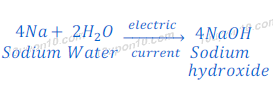
अल्युमिनियम धातु का निष्कर्षण
सोडियम की तरह ही अल्युमिनियम धातु का निष्कर्षण वैद्युत अपघटनी उपचय विधि द्वारा किया जाता है।
जब पिघली हुई अल्युमिनियम ऑक्साईड के द्वारा विद्युत धारा प्रवाहित की जाती है तो, अल्युमिनियम आयन धनावेशित होने के कारण ऋण ध्रुव की ओर आसर्षित होता है जहाँ अल्युमिनिय्म आयन इलेक्ट्रॉन प्राप्त करता है तथा अल्युमिनियम धातु के रूप में बदल जाता है।
दूसरी तरफ ऑक्साईड आयन ऋण आवेशित होने के कारण धन ध्रुव की ओर आकर्षित होता है जहाँ पर ऑक्साईड आयन इलेक्ट्रॉन खोता है तथा ऑक्सीजन गैस के रूप में बदल जाता है।


धातुओं का परिष्करण (Refining of metals)
निष्कर्षण की विभिन्न विधियों द्वारा प्राप्त धातुओं में कई तरह की अशुद्धियाँ होती हैं। अत: इन प्राप्त धातु का परिष्करण कर शुद्ध धातु प्राप्त किया जाता है।
शुद्ध धातु प्राप्त करने की कई विधियाँ हैं लेकिन वैद्युत अपघटनी परिष्करण एक प्रचलित विधि है। इस विधि द्वारा ताम्बा, सोना, चाँदी, जिंक, टिन आदि धातुओं का परिष्करण किया जाता है।
वैद्युत अपघटनी परिष्करण विधि में अशुद्ध धातु का एक मोटा ब्लॉक लिया जाता है तथा उसे विद्युत के धन ध्रुव से जोड़ दिया जाता है। शुद्ध धातु का एक पतला टुकड़ा लेकर उसे ऋण ध्रुव से जोड़ दिया जाता है। संबंधित धातु का पानी में घुलनशील लवण लेकर उसका उपयोग इलेक्ट्रोलाईड के रूप में किया जाता है। जब इसमें विद्युत धारा प्रवाहित की जाती है तो, अशुद्ध धातु एनोड से घुलकर शुद्ध धातु के रूप में कैथोड पर जमा होता है। धातु में उपस्थित अघुलनशील अशुद्धियाँ एनोड मड के रूप में तली में जम जाता है जबकि धातु में उपस्थित घुलनशील अशुद्धियाँ इलेक्ट्रोलाइट में घुल जाती है।
इस तरह कैथोड पर शुद्ध धातु प्राप्त होता है।
उदाहरण:
कॉपर का विद्युत परिष्करण (Electrolytic Refining of copper)
कॉपर ऑक्साइड के अवकरण से प्राप्त कॉपर धातु से विद्युत परिष्करण विधि द्वारा शुद्ध धातु प्राप्त किया जाता है।
अशुद्ध कॉपर का एक मोटा तथा शुद्ध कॉपर का एक पतला टुकड़ा लिया जाता है। इन दोनों टुकड़ों को कॉपर स्ल्फेट के घोल में डुबा दिया जाता है। कॉपर के अशुद्ध टुकड़े को विद्युत धारा के धन ध्रुव से तथा कॉपर के शुद्ध टुकड़े को ऋण ध्रुव से जोड़ दिया जाता है।
जब इससे विद्युत धारा प्रवाहित की जाती है तो, अशुद्ध टुकड़े से कॉपर धातु घुलकर कैथोड पर कॉपर के शुद्ध टुकड़े पर जमा हो जाता है। कॉपर में वर्तमान घुलनशील अशुद्धियाँ इलेक्ट्रोलाइट में घुल जाती है तथा अघुलनशील अशुद्धियाँ एनोड मड के रूप में तल में जमा हो जाता है।
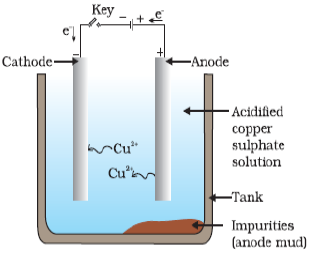
Ref: Image taken from NCERT Book
इस प्रक्रिया में कापर धातु अशुद्ध टुकड़े से इलेक्ट्रॉन खोता है तथा कॉपर आयन बनाता है। कॉपर आयन धन आवेशित होने के कारण ऋण ध्रुव की ओर आकर्षित होता है तथा कैथोड पर इलेक्ट्रॉन प्राप्त कर कॉपर धातु में बदलकर जमा हो जाता है।

इस प्रक्रिया में प्राप्त धातु शुद्ध होता है।
Reference: