अम्ल, भस्म तथा लवण - क्लास दसवीं विज्ञान
Back to 10th-science-home(Hindi)
उदासीनीकरण अभिक्रिया
न्युट्रलाइजेशन प्रतिक्रिया के उपयोग (Use of Neutralization Reaction):
Acidity (एसिडिटी) :
एसिडिटि एक मेडिकल अवस्था है जिसमें रोगी पेट में मरोड के साथ दर्द तथा असहज महसूस करता है। एसिडिटि प्राय: अधिक खाने के कारण होता है। ज्यादा खाने की वजह से हमारा पाचन तंत्र अधिक खाने के पाचन के लिये ज्यादा अम्ल (एसिड) बनाता है, जिसके कारण एक व्यक्ति एसिडिटि का शिकार हो जाता है।
एसिडिटि की स्थिति में डॉक्टर एंटासिड लेने की सलाह देता है। एंटासिड घोल या टैब्लेट के रूप में मिलता है। एंटासिड का अर्थ वैसा पदार्थ जो एसिड के एंटी अर्थात एसिड के विपरीत कार्य करे। एंटासिड एक क्षार या क्षारक (Base) है। प्रायः मिल्क ऑफ मैग्निशिया का उपयोग एंटासिड के रूप में होता है।
एंटासिड (Base) पेट में पहुँचकर जरूरत से ज्यादा Produced एसिड को उदासीन (neutralize) कर देता है। एसिड के उदासीन (Neutralize) होने के बाद एसिडिटी से पीडित व्यक्ति को आराम मिलता है।
Bee sting (मधुमक्खी का डंक):
मधुमक्खी डंक के सहारे स्किन (Skin) के अंदर जहर भेज (Push कर) देता है, जो एसिडिक होता। चूँकि मधुमक्खी के डंक के सहारे push किया हुआ जहर आम्लिक होता है अतः डंक किये हुए जगह पर Skin के उपर कोई भी हल्का (Mild) क्षार या क्षारक (Base) (जैसे कि खाने वाला सोडा या वाशिंग सोडा आदि) मलने से डंक से पीडित व्यक्ति को आराम मिलता है। क्योंकि क्षार या क्षारक (Base) एसिड (Acid) को उदासीन (Neutralise) कर देता है।
Wasp sting (हड्डे का डंक):
हड्डे का डंक क्षारीय होता है। इसलिये डंक किये हुए जगह पर आम्लिक पदार्थ जैसे कि नींबू, सिरका आदि मलने पर हड्डे के डंक से पीडित व्यक्ति को आराम मिलता है। क्योंकि एसिड डंक के क्षारीय जहर को उदासीन (neutralize) बना देता है।
एसिड का मेटल ऑक्साइड के साथ प्रतिक्रिया (Reaction of Acids with Metallic Oxide)
मेटल ऑक्साइड को क्षारीय ऑक्साइड भी कहा जाता है क्योंकि मेटल ऑक्साइड क्षारीय होता है। अतः जब मेटल ऑक्साइड एसिड के प्रतिक्रिया करता है तो संबंधित लवण तथा पानी बनाता है।
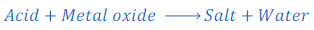
उदाहरणः
(1)जब हाइड्रोक्लोरिक अम्ल [Hydrochloric acid(HCl)] कॉपर ऑक्साइड [Copper oxide (CuO)] से प्रतिक्रिया करता है तो कॉपर क्लोराइड [Copper chloride (CuCl2)] तथा पानी बनता है।
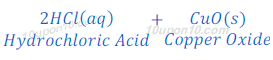
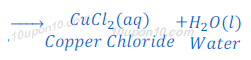
कॉपर ऑक्साइड का रंग काला होता है परंतु हाइड्रोक्लोरिक अम्ल [Hydrochloric acid(HCl)] से प्रतिक्रिया के बाद कॉपर क्लोराइड [Copper chloride (CuCl2)] बनने के कारण यह हरे रंग में बदल जाता है।
(2) जब हाइड्रोक्लोरिक अम्ल [Hydrochloric acid(HCl)] कैल्शियम ऑक्साइड [Calcium oxide (CaO)] के साथ प्रतिक्रिया करता है तो कैल्शियम क्लोराइड [Calcium chloride (CaCl2)] तथा पानी बनता है।
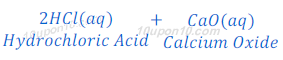
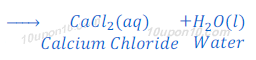
अधातु के ऑक्साइड का क्षार या क्षारक (Base) के साथ प्रतिक्रिया (Reaction of a Non-metallic Oxide with Base):
अधातु के ऑक्साइड (Non-metallic oxides) आम्लिक (Acidic) होते हैं। जैसे कि कार्बन डाइऑक्साइड [Carbon dioxide (CO2)], सल्फर डाइऑक्साइड[Sulphur dioxide (SO2)], इत्यादि। जब कार्बन डाइऑक्साइड [Carbon dioxide (CO2)] को पानी में घुलाया जाता है तो कार्बोनिक अम्ल बनता है। जब सल्फर डाइऑक्साइड[Sulphur dioxide (SO2)] को पानी में घुलाया जाता है तो सल्फोनिक अम्ल बनता है।
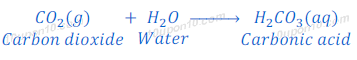
अतः जब अधातु के ऑक्साइड (Non-metallic oxides) क्षार या क्षारक (Base) के साथ प्रतिक्रिया करता है तो संबंधिल लवण तथा पानी बनाता है।
अधातु के ऑक्साइड + क्षार या क्षारक → लवण + पानी
उदाहरण:
(1) जब कार्बन डाइऑक्साइड [Carbon dioxide (CO2)] अधातु के ऑक्साइड (Oxides of non metals) जैसे कि सोडियम हाइड्रोक्साइड [Sodium hydroxide (NaOH)] के साथ प्रतिक्रिया करता है तो सोडियम कार्बोनेट [Na2CO3] तथा पानी बनाता है।
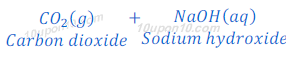
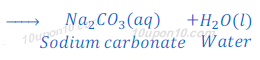
(2)जब सल्फर डाइऑक्साइड [Sulphur dioxide (SO2)], जो कि एक अधातु (Non-metal), सल्फर (sulphur) का ऑक्साइड (oxide) है, सोडियम हाइड्रोक्साइड [Sodium hydroxide (NaOH)] के साथ प्रतिक्रिया करता है तो सोडियम सल्फाइड [Sodium sulphide (Na2S)]तथा पानी बनाता है।
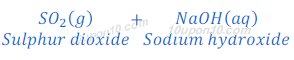
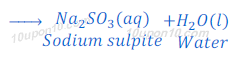
एसिड तथा क्षार या क्षारक (Base) में उभयनिष्ठ (What do all Acids and All Bases have in Common?)
सभी एसिड (Acid) धातु (Metla) के साथ प्रतिक्रिया कर हाइड्रोजन गैस [Hydrogen gas (H2)]बनाते हैं। अतः यह कहा जा सकता है कि सभी एसिड (Acid) में हाइड्रोजन मौजूद है। जैसे कि: हाइड्रोक्लोरिक अम्ल [Hydrochloric acid (HCl)], सल्फ्युरिक अम्ल [Sulphuric acid (H2SO4)], नाइट्रिक अम्ल [Nitric acid (HNO3)], एसेटिक अम्ल [Acetic acid (CH3COOH)] इत्यादि में हाइड्रोजन है।
लेकिन वैसे सभी यौगिक (Compound) जिसमें हाइड्रोजन (Hydrogen) हैं एसिड (Acid) नहीं हैं। जैसे कि: ग्लुकोज (Glucose), अल्कोहल (Alcohol), इत्यादि में हाइड्रोजन (Hydrogen) तो है परंतु ये अम्ल (Acid) नहीं हैं।
दूसरी तरफ सभी क्षार या क्षारक (Base) भी मेटल (metal) के साथ प्रतिक्रिया कर हाइड्रोजन गैस बनाते हैं। इसका अर्थ यह हुआ कि सभी क्षार या क्षारक (Base) में भी हाइड्रोजन [Hydrogen (H2)] है।
अर्थात अम्ल तथा क्षार या क्षारक (Base) दोनों में ही किसी न किसी रूप में हाइड्रोजन है।
अम्ल जलीय घोल में विद्युत (Electricity) का संवहन करता है (Acids conduct electricity in aqueous solution)
विद्युत (Electricity) का जलीय घोल में संवहन (Conduction) घोल में वर्तमान मुक्त आयन (free ions) पर निर्भर करता है। जब अम्ल (acid) को पानी में घोला जाता है तो अम्ल का जलीय घोल (aqueous solution of acid) इलेक्ट्रिक (electric) का संवहन (conduct) करता है।
अम्ल (acid) के जलीय घोल (aqueous solution) में इलेक्ट्रिक का संवहन (conduction of electricity) दर्शाता है कि अम्ल जलीय घोल में हाइड्रोजन आयन देता है। यही हाइड्रोजन आयन [hydrogen ions (H+(aq))] जलीय घोल में इलेक्ट्रिक का संवहन करता है।
क्या होता है जब अम्ल (acid) या क्षारक (Base) का पानी में घोल बनाया जाता है? (What happens to an Acid or a Base in Water Solution?)
अम्ल (Acid) का जलीय घोल (Acid in water solution)
जब अम्ल को पानी में घोला जाता है तो हाइड्रोजन आयन [hydrogen ions (H+(aq))] देता है।
उदाहरण:
जब हाइड्रोक्लोरिक अम्ल का पानी में घोल बनाया जाता है तो यह हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा क्लोराइड आयन [chloride ion (Cl?)] में टूट जाता है।
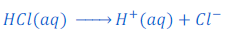
जब सल्फ्युरिक अम्ल [Sulphuric acid (H2SO4)] को पानी में घोला जाता है तो यह हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा सल्फेट आयन [Sulphate ion (SO4? ?)] में टूट जाता है।
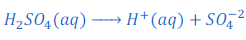
जब नाइट्रिक अम्ल [Nitric acid (HNO3)] को पानी में घोला जाता है तो यह हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा नाइट्रेट आयन [Nitrate ion (NO3?)] में टूट जाता है।
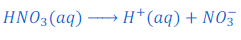
जब एसेटिक अम्ल [acetic acid (CH3COOH)] को पानी में घोला जाता है तो यह हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा एसिटेट आयन [acetate ion (CH3COO?)] में टूट जाता है।
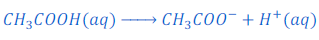
क्या अम्ल पानी की अनुपस्थिति में भी हाइड्रोजन आयन [hydrogen ions (H+(aq))] देता है? (Is an acid produces hydrogen ion in absence of water?)
अम्ल पानी की अनुपस्थिति में हाइड्रोजन आयन [hydrogen ions (H+(aq))] नहीं देता है। एसिड के हाइड्रोजन आयन [hydrogen ions (H+(aq))] देने के लिये पानी आवश्यक है।
इसे एक प्रयोग के द्वारा दर्शाया जा सकता है।
जब सोडियम क्लोराइड सल्फ्युरिक अम्ल के साथ प्रतिक्रिया करता है तो यह शुष्क हाइड्रोक्लोरिक गैस बनाता है।
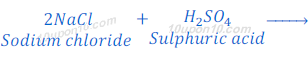
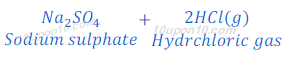
जब ब्लू रंग के एक सूखे लिटमस पेपर को हाइड्रोक्लोरिक गैस के पास ले जाया जाता है तो लिटमस पेपर का रंग में कोई परिवर्तन नहीं होता है। परंतु पानी से गीले ब्लू रंग के लिटमस पेपर को हाइड्रोक्लोरिक गैस के पास लाने पर लिटमस पेपर का रंग लाल हो जाता है।
यह प्रयोग दर्शाता है कि बिना पानी के एसिड हाइड्रोजन आयन [hydrogen ions (H+(aq))] नहीं देता है बल्कि हाइड्रोजन आयन [hydrogen ions (H+(aq))] देने के लिये पानी आवश्यक है।
जब एसिड को पानी में घोला जाता है तो एसिड के द्वारा दिया गया हाइड्रोजन आयन [hydrogen ions (H+(aq))] पानी के अणु के साथ जुड्कर हाइड्रोनियम आयन [Hydronium ion (H3O+)] बनाता है। ऐसा इसलिये होता है कि हाइड्रोजन आयन [hydrogen ions (H+(aq))] स्वतंत्र रूप में नहीं रह सकता है।
एसिड के हाइड्रोजन आयन [hydrogen ions (H+(aq))] देने तथा हाइड्रोनियम आयन [Hydronium ion (H3O+)] बनाने से संबंधित प्रतिक्रिया को निम्नांकित रूप से दर्शाया जा सकता है।
HCl + H2 ⇒ H+ + H2O + Cl? ⇒ H3O+ + Cl?
इसे निम्नांकित प्रकार से भी लिखा जा सकता हैः
H+ + H2O ⇒ H3O+
हाइड्रोजन आयन को हमेशा [H+(aq)] लिखा जाता है। हाइड्रोजन आयन के सिम्बॉल को लिखने के बाद हमेशा ?aq? ब्रैकेट के अंदर लिखा जाता है। यह पानी की उपस्थिति को दर्शाता है।
या हाइड्रोजन आयन को हाइड्रोनियम आयन (H3O+) लिखा जाता है।
उदाहरण:

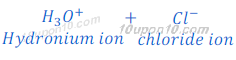
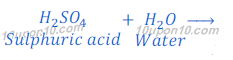
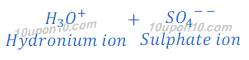
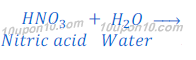
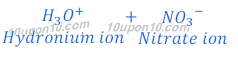
Reference: