अम्ल, भस्म तथा लवण - क्लास दसवीं विज्ञान
Back to 10th-science-home(Hindi)
क्षारक का जलीय विलयन
जब क्षार या क्षारक (Base) को पानी में घोला जाता है तो यह हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
उदाहरण्:
जब सोडियम हाइड्रोक्साइड [Sodium hydroxide (NaOH)] का पानी में घोल बनाया जाता है तो यह हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
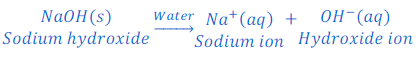
जब कैल्शियम हाइड्रोक्साइड [Calcium hydroxide (Ca(OH)2)] को पानी में घोला जाता है तो यह हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
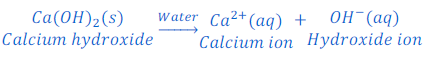
जब पोटैशियम हाइड्रोक्साइड [Potassium hydroxide (KOH)] को पानी में घोला जाता है तो यह हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
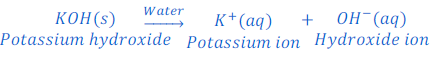
जब अमोनियम हाइड्रोक्साइड [Ammonium hydroxide (NH4OH)] को पानी में घोला जाता है तो यह हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
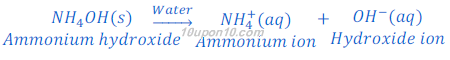
मैग्नेशियम हाइड्रोक्साइड [Magnesium hydroxide (Mg(OH)2)], जो कि एक क्षार है, पानी में पूरी तरह घुलनशील नहीं है, परंतु यह भी पानी में हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
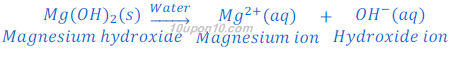
अमोनिया गैस क्षारीय है तथा पानी में घुलनशील है। जब अमोनिया गैस को पानी में घुलाया जाता है तो यह अमोनियम हाइड्रोक्साइड बनाता है, जो कि हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है।
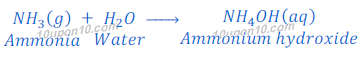
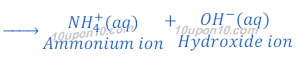

क्या क्षार (Base) पानी की अनुपस्थिति में हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है?( Is a base produce hydroxide ion in absence of water? )
अम्ल की तरह ही क्षार (Base) भी बिना पानी के हाइड्रोक्साइड आयन [hydroxide ions (OH?)] नहीं देता है। लेकिन क्षार पिघली अवस्था (Molten state) में हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है। यही कारण है कि क्षार (Base) पिघली अवस्था में इलेस्ट्रिसिटि (Electricity) का सुचालक (Good conductor) होता है अर्थात संवहन (Conduct) करता है।
न्युट्रलाइजेशन प्रतिक्रिया कैसे सम्पादित होता है। (How neutralization reaction takes place):
अम्ल हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा क्षार हाइड्रोक्साइड आयन [hydroxide ions (OH?)] देता है। अतः जब एक अम्ल तथा क्षार प्रतिक्रिया करता है तो अम्ल द्वारा दिये गये हाइड्रोजन आयन हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा क्षार द्वारा दिया गया हाइड्रोक्साइड आयन हाइड्रोक्साइड आयन [hydroxide ions (OH?)] मिलकर पानी का अणु (Molecule) बनाता है। इस तरह अम्ल तथा क्षार एक दूसरे को उदासीन (Neutralize) बना देते हैं। अम्ल (Acid) तथा क्षार (Base) के बीच प्रतिक्रिया में पानी के साथ साथ संबंधित लवण (Salt) भी बनता है।
दूसरे शब्दों में हाइड्रोजन आयन [hydrogen ions (H+(aq))] तथा हाइड्रोक्साइड आयन [hydroxide ions (OH?)] एक दूसरे को उदासीन बना देते हैं।
Acid + Base ⇒ Salt + Water
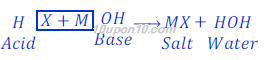
यहाँ X अम्ल का एनायन (negative ion) तथा M क्षार के कैटायन (positive ion) को दर्शाता है।
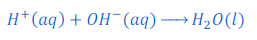
pH स्केल तथा अम्ल एवं क्षारक
अम्ल तथा क्षार का जलीय घोल कितना शक्तिशाली है? (How strong are Acid or Base Solutions?)
विशुद्ध पानी (distilled water) में हाइड्रोजन आयन तथा हाइड्रोक्साइड आयन की सान्द्र्ता बराबर होती है। अतः विशुद्ध पानी (distilled water) न तो आम्लिक होता है और न ही क्षारीय।
यदि किसी घोल में हाइड्रोजन आयन का concentration हाइड्रोक्साइड आयन के concentration से ज्यादा होगा तो वह घोल आम्लिक होगा तथा यदि हाइड्रोक्साइड आयन का concentration हाइड्रोजन आयन के concentration से ज्यादा होगा तो वह घोल क्षारीय होगा।
अम्ल भस्म सूचक (Acid base indicator) से केवल अम्ल (acid) तथा भस्म (base) की पहचान की जा सकती है। लेकिन अम्ल भस्म सूचक (Acid base indicator) से अम्ल या भस्म के शक्ति (strength of acid or base) को नहीं पहचाना जा सकता है अर्थात अम्ल भस्म सूचक (Acid base indicator) के उपयोग से यह नहीं जाना जा सकता है कि कोई भी अम्ल या भस्म कितना शक्तिशाली है।
चूँकि जलीय घोल (Aqueous solution) में एक अम्ल हाइड्रोजन आयन (Hydrogen ion) देता है तथा एक क्षार (base) हाइड्रोक्साइड आयन (Hydroxide ion) देता है अतः हाइड्रोजन आयन की सान्द्र्ता (concentration) जानकर या उसकी गणना कर अम्ल या क्षार की शक्ति ज्ञात की जा सकती है
हाइड्रोजन आयन की अधिक सान्द्र्ता (concentration) वाले अम्ल (acid), हाइड्रोजन आयन की कम सान्द्र्ता (concentration) वाले अम्ल से ज्यादा शक्तिशाली होता है। उसी प्रकार हाइड्रोक्साइड आयन की अधिक सान्द्र्ता (concentration) वाले क्षार (base), हाइड्रोक्साइड आयन की कम सान्द्र्ता (concentration) वाले क्षार (base) से ज्यादा शक्तिशाली होता है।
Example:
चूँकि एसिटिक अम्ल (Acetic acid) की तुलना में समान सान्द्रता (same concentration) वाला हाइड्रोक्लोरिक अम्ल (Hydrochloric acid) ज्यादा हाइड्रोजन आयन देता है। अतः हाइड्रोक्लोरिक अम्ल एसिटिक अम्ल की तुलना में ज्यादा शक्तिशाली अम्ल है।
pH स्केल (pH scale):
हाइड्रोजन आयन की सान्द्रता (Concentration) pH स्केल के उपयोग से मापा जा सकता है।
pH शब्द में, p का अर्थ पोटेंशी (Potency) या पावर (Power) होता है तथा H का अर्थ है हाइड्रोजन आयन। pH शब्द में, p जर्मनी के शब्द 'potenz' से आया है जिसका अर्थ है पावर। अतः pH को पावर ऑफ एसिड (Power of acid) कहा जा सकता है।
pH स्केल एक टूल है जिसके द्वारा हाइड्रोजन आयन की सान्द्रता मापी जा सकती है।
pH की परिभाषा (Definition of pH):
pH किसी घोल में हाइड्रोजन आयन के व्युत्क्रम का लॉग (aH+) है। (pH is defined as the decimal logarithm of the reciprocal of the hydrogen ion activity (aH+), in a solution]

pH स्केल 0 to 14 के मान के बीच कार्य करता है। [pH scale works between the value of 0 to 14 (zero to fourteen)]
pH स्केल पर 0 मान सबसे शक्तिशाली अम्ल को सूचित करता है। [0 (zero) value on pH scale indicates highly acidic (strongest acid)]
pH स्केल पर 7 (seven) मान सबसे उदासीन घोल को सूचित करता है। [7 (seven) value on pH scale indicates the neutral solution]
pH स्केल पर 14 (14) मान सबसे शक्तिशाली क्षार को सूचित करता है। 14 (fourteen) value on pH scale indicates highly basic (strongest base)
pH स्केल पर मान 7 (seven) से 0 (zero) तक घटने के साथ अम्ल की की शक्ति बढती है।
उसी प्रकार pH स्केल पर मान 7 (seven) से 14 (fourteen) तक बढने के साथ क्षार की की शक्ति बढती है।
अतः pH स्केल पर मान अम्ल की सान्द्रता का मान जानकर अम्ल की शक्ति निकाली या जानी जा सकती है।
युनिवर्सल सूचक (Universal indicator):
युनिवर्सल इंडिकेटर (Universal indicator) बहुत सारे यौगिकों (Compounds) का मिश्रण होता है। युनिवर्सल इंडिकेटर (Universal indicator) में प्रायः पानी, propane-1-ol, phenolphthalein, sodium salt, sodium hydroxide, methyl red, bromothyomol blue monosodium लवण तथा thyomol blue monosodium लवण होता है। युनिवर्सल इंडिकेटर (Universal indicator) pH स्केल के 1 से 14 मान के लिये विभिन्न तरह का रंग दर्शाता है। pH स्केल पर विभिन्न मान घोल के एसिडिटी (Acidity) तथा बेसिसिटी (Basicity) को सूचित करता है या दर्शाता है।
युनिवर्सल इंडिकेटर (Universal indicator) के साथ रंगों का चार्ट होता है जो pH स्केल के अलग अलग मानों के लिये एक अलग रंग पर आधारित होता है।
युनिवर्सल इंडिकेटर (Universal indicator) पेपर स्ट्रिप तथा घोल दोनों प्रकार का होता है।
जब युनिवर्सल इंडिकेटर (Universal indicator) पेपर स्ट्रिप को घोल में डुबाया जाता है तो पेपर स्ट्रिप का रंग बदल जाता है। बदले हुए रंग को रंग तालिका से मिलाकर pH का मान ज्ञात किया जाता। pH के मान के आधार पर घोल के अम्ल या क्षार की शक्ति ज्ञात की जाती है।
कुछ द्र्वों का pH स्केल पर मान
| pH value of some common liquids | |
|---|---|
| pH | Name of Liquids |
| 0 | Battery acid |
| 1 | Sulphuric acid, Gastric juice (1.2) |
| 2 | Lemon juice, vinegar |
| 3 | Orange juice, soda |
| 4 | Totamo juice, acid rain |
| 5 | Black coffee, bananas |
| 6 | Urine, milk |
| 7 | Pure water, blood (7.4) |
| 8 | Sea water, egg |
| 9 | Baking soda |
| 10 | Milk of magnesia |
| 11 | Ammonium solution |
| 12 | Soapy water |
| 13 | Bleach, oven cleaner |
| 14 | Liquid drain cleaner, sodium hydroxide solution |
Reference: